1. NÁZEV PŘÍPRAVKU
Aimovig 70 mg injekční roztok v předplněné injekční stříkačce
Aimovig 140 mg injekční roztok v předplněné injekční stříkačce
Aimovig 70 mg injekční roztok v předplněném peru
Aimovig 140 mg injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Aimovig 70 mg injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje erenumabum 70 mg.
Aimovig 140 mg injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje erenumabum 140 mg.
Aimovig 70 mg injekční roztok v předplněném peru
Jedno předplněné pero obsahuje erenumabum 70 mg.
Aimovig 140 mg injekční roztok v předplněném peru
Jedno předplněné pero obsahuje erenumabum 140 mg.
Erenumab je plně humánní IgG2 monoklonální protilátka produkovaná za použití rekombinantní DNA technologie v buňkách ovarií čínského křečíka (CHO).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce)
Roztok je čirý až opalizující, bezbarvý až nažloutlý.
4. KLINICKÉ ÚDAJE
-
4.1 Terapeutické indikace
Přípravek Aimovig je indikován k profylaxi migrény u dospělých, kteří trpí migrénou nejméně 4 dny v měsíci.
-
4.2 Dávkování a způsob podání
Léčba musí být zahájena lékařem se zkušeností v diagnostice a terapii migrény.
-
Dávkování
Léčba je určena pro pacienty, kteří při zahájení terapie přípravkem Aimovig trpí migrénou nejméně 4 dny v měsíci.
Doporučená dávka je 70 mg erenumabu každé 4 týdny. U některých pacientů může být prospěšné podat dávku 140 mg každé 4 týdny (viz bod 5.1).
Dávku 140 mg je nutné podat buď jako jednu podkožní 140mg injekci nebo jako dvě podkožní 70mg injekce.
Klinické studie prokázaly, že u většiny pacientů odpovídajících na léčbu se dostavil klinický přínos během 3 měsíců terapie. U pacientů, kteří neodpovídají na léčbu po 3 měsících terapie, je nutné zvážit přerušení léčby. Následně se doporučuje pravidelně vyhodnocovat nutnost pokračování v léčbě.
Zvláštní populace
Starší osoby (ve věku 65 let a více)
Přípravek Aimovig nebyl u starších pacientů hodnocen. Úprava dávky není nutná, protože farmakokinetika erenumabu není ovlivněna věkem.Porucha funkce ledvin / Porucha funkce jater
U pacientů s lehkou až středně těžkou poruchou funkce ledvin nebo jater není úprava dávky nutná (viz bod 5.2).Pediatrická populace
Bezpečnost a účinnost přípravku Aimovig u dětí a dospívajících do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
-
Způsob podání
Přípravek Aimovig je určen k subkutánnímu podání.
Přípravek Aimovig je určen k samoaplikaci pacientem po příslušném zaškolení. Injekce může též podat jiná, příslušně proškolená osoba. Injekci je možné aplikovat do břicha, stehna nebo vnější části paže (paži lze použít, pouze pokud injekci podává jiná osoba než pacient, viz bod 5.2). Místa vpichu je nutné měnit a injekce nesmí být podána do míst, kde je pokožka citlivá na dotek, poškozená, zarudlá nebo ztvrdlá.
Předplněná injekční stříkačka
Je nutné podat celý obsah předplněných injekčních stříkaček přípravku Aimovig. Předplněné injekční stříkačky jsou na jednorázové použití a umožňují podání celého obsahu beze zbytku.Podrobné instrukce k podání najdete v návodu k použití v příbalové informaci.
Předplněné pero
Je nutné podat celý obsah předplněných per přípravku Aimovig. Předplněná pera jsou na jednorázové použití a umožňují podání celého obsahu beze zbytku.Podrobné instrukce k podání najdete v návodu k použití v příbalové informaci.
-
-
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
-
4.4 Zvláštní upozornění a opatření pro použití
-
Sledovatelnost
Aby se zlepšila sledovatelnost biologických léčivých přípravků, má se přehledně zaznamenat název podaného přípravku a číslo šarže.
-
Kardiovaskulární účinky
Pacienti s některými závažnými kardiovaskulárními chorobami byli z účasti v klinických studiích vyloučeni (viz bod 5.1). U těchto pacientů nejsou k dispozici údaje o bezpečnosti.
-
Hypersenzitivní reakce
Po uvedení přípravku na trh byly u erenumabu hlášeny závažné hypersenzitivní reakce včetně vyrážky, angioedému a anafylaktických reakcí. Tyto reakce se mohou objevit během několika minut, i když některé se mohou objevit i později než týden po léčbě. V této souvislosti musí být pacienti upozorněni na symptomy spojené s hypersenzitivními reakcemi. Pokud se objeví závažná nebo silná hypersenzitivní reakce, je třeba zahájit vhodnou terapii a léčba erenumabem musí být vysazena (viz bod 4.3).
-
Zácpa
Zácpa je častým nežádoucím účinkem erenumabu a je obvykle lehká nebo středně těžká. Ve většině případů byl nástup hlášen po první dávce erenumabu; nicméně u pacientů se zácpa objevila i později během léčby. Ve většině případů zácpa odezněla do tří měsíců. V období po uvedení přípravku na trh byla u erenumabu hlášena zácpa se závažnými komplikacemi. V některých případech byla nutná hospitalizace, včetně případů, kdy byl nutný chirurgický zákrok. Zácpa v anamnéze nebo současné užívání léčivých přípravků spojených se sníženou gastrointestinální motilitou může zvýšit riziko závažnější zácpy a možnosti komplikací souvisejících se zácpou. Pacienti mají být upozorněni na riziko zácpy a musí být poučeni, aby vyhledali lékařskou pomoc v případě, že zácpa nezmizí nebo se zhorší. Pokud se u pacientů objeví zácpa, mají okamžitě vyhledat lékařskou pomoc. Zácpa musí být léčena neprodleně, jakmile je to z klinického hlediska vhodné. Při těžké zácpě má být zváženo přerušení léčby.
-
Osoby citlivé na kaučuk (latex)
Kryt jehly léčivého přípravku obsahuje kaučuk. Může způsobit těžké alergické reakce.
-
Obsah sodíku
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, to znamená, že je v podstatě „bez sodíku“
-
-
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vzhledem k metabolickým cestám monoklonálních protilátek se neočekává vliv na expozici současně podaných léčivých přípravků. Ve studii se zdravými dobrovolníky nebyla pozorována interakce s perorálními kontraceptivy (ethinylestradiol/norgestimát).
-
4.6 Fertilita, těhotenství a kojení
-
Těhotenství
Údaje o podávání erenumabu těhotným ženám jsou omezené. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3). Podávání přípravku Aimovig v těhotenství se z preventivních důvodů nedoporučuje.
-
Kojení
Není známo, zda je erenumab vylučován do lidského mateřského mléka. O lidském IgG známo, že je vylučován do mateřského mléka prvních několik dní po porodu, následně jeho koncentrace klesá na nízké hodnoty, což nicméně znamená, že během tohoto krátkého období riziko pro kojené dítě nelze vyloučit. Proto je o používání přípravku Aimovig během kojení možné uvažovat pouze v případech, kdy je to klinicky nezbytné.
-
Fertilita
Studie na zvířatech neprokázaly vliv na samičí a samčí fertilitu (viz bod 5.3).
-
-
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Aimovig nemá žádný nebo má jen zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
-
4.8 Nežádoucí účinky
-
Souhrn bezpečnostního profilu
Celkem bylo přípravkem Aimovig v registračních studiích léčeno více než 2 500 pacientů (více než 2 600 pacientoroků). Z nich bylo více než 1 300 pacientů exponováno nejméně 12 měsíců a 218 pacientů bylo exponováno po dobu 5 let. Celkový bezpečnostní profil přípravku Aimovig zůstal konzistentní po dobu 5 let dlouhodobé otevřené léčby.
Hlášené nežádoucí účinky u dávky 70 mg a 140 mg byly reakce v místě vpichu (5,6 %/4,5 %), zácpa (1,3 %/3,2 %), svalové křeče (0,1 %/2,0 %) a pruritus (0,7 %/1,8 %). Většina reakcí byla lehká až středně těžká. Méně než 2 % pacientů v těchto studiích ukončilo účast kvůli nežádoucím účinkům.
-
Tabulkový přehled nežádoucích účinků
V tabulce 1 jsou uvedeny všechny nežádoucí účinky, které se objevily u pacientů léčených přípravkem Aimovig během 12týdenního placebem kontrolovaného období studií, i po uvedení na trh. V každé třídě orgánových systémů jsou nežádoucí účinky řazeny podle frekvence, s nejčastějšími nežádoucími účinky nejdřív. V rámci každé skupiny četnosti jsou nežádoucí účinky řazeny podle klesající závažnosti. Navíc jsou odpovídající frekvenční kategorie pro všechny nežádoucí účinky založeny na následující konvenci: velmi časté (≥1/10); časté (≥1/100 až <1/10); méně časté (≥1/1 000 až <1/100); vzácné (≥1/10 000 až <1/1 000); velmi vzácné (<1/10 000); není známo (z dostupných údajů nelze určit).
Tabulka 1 Přehled nežádoucích účinků z klinických studií
Třídy orgánových systémů Nežádoucí účinek Frekvence Poruchy imunitního systému Hypersenzitivní reakcea včetně anafylaxe, angioedému, vyrážky, zduření/edému a kopřivky Časté Gastrointestinální poruchy Zácpa Časté Vředy v ústechb Není známo Poruchy kůže a podkožní tkáně Pruritusc Časté Alopecie
VyrážkadNení známo Poruchy svalové a kosterní soustavy a pojivové tkáně Svalové křeče Časté Celkové poruchy a reakce v místě aplikace Reakce v místě vpichua Časté a Viz bod „Popis vybraných nežádoucích účinků”
b Vředy v ústech zahrnují preferované termíny stomatitida, ulcerace v ústech, puchýře na ústní
sliznici.
c Pruritus zahrnuje preferované termíny generalizovaný pruritus, pruritus a pruritická vyrážka.
d Vyrážka zahrnuje preferované výrazy papulózní vyrážka, exfoliativní vyrážka, erytematózní vyrážka, kopřivka, puchýř.
-
Popis vybraných nežádoucích účinků
Reakce v místě vpichu
V integrované 12týdenní placebem kontrolované fázi studií byly reakce v místě vpichu lehké a většinou přechodné. Byl zaznamenán jeden případ přerušení léčby u pacienta léčeného dávkou 70 mg kvůli vyrážce v místě vpichu. Nejčastější reakce v místě vpichu byly lokalizovaná bolest, erytém a pruritus. Bolest v místě vpichu typicky odezněla během jedné hodiny po podání injekce.Kožní a hypersenzitivní reakce
Během integrované 12týdenní placebem kontrolované studie byly pozorovány nezávažné případy vyrážky, svědění a zduření/edému, z nichž většina byla mírná, a nevedly k přerušení léčby.V postmarketingovém období byly pozorovány případy anafylaxe a angioedému.
Imunogenita
Během dvojitě zaslepené fáze léčby v klinických studiích byla četnost vzniku protilátek proti erenumabu 6,3% (56/884) u subjektů s dávkou 70 mg erenumabu (3 z nich vykazovali neutralizační aktivitu in vitro) a 2,6% (13/504) u subjektů s dávkou 140 mg erenumabu (žádný nevykazoval neutralizační aktivitu in vitro). V otevřené studii s délkou léčby až 256 týdnů byla incidence vývoje protilátek proti erenumabu 11,0% (25/225) u pacientů, kteří dostávali pouze 70 mg nebo 140 mg přípravku Aimovig po celou dobu studie (2 z nich vykazovali neutralizační aktivitu in vitro). Vznik protilátek proti erenumabu neměl dopad na účinnost a bezpečnost erenumabu.
-
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky přímo na níže uvedenou adresu.
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
-
-
4.9 Předávkování
V klinických studiích nebyly hlášeny případy předávkování.
Během klinických studií byly subkutánně podány dávky až 280 mg bez známek dávku omezující toxicity.
V případě předávkování je nutné pacienta léčit symptomaticky a v případě potřeby zavést vhodná podpůrná opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
-
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika, antimigrenika, ATC kód: N02CD01
-
Mechanismus účinku
Erenumab je humánní monoklonální protilátka, která se váže na kalcitoninu příbuzný peptid (alcitonin gene-related peptide, CGRP). CGRP receptor se nachází v místech relevantních pro patofyziologii migrény, jako je ganglion trigeminale. Erenumab silně a specificky soutěží o vazebné místo s CGRP a inhibuje jeho vliv na CGRP receptor a současně nevykazuje významnou aktivitu vůči jiným receptorům kalcitoninové rodiny.
CGRP je neuropeptid, který moduluje nociceptivní signalizaci, a vasodilatátor spojovaný s patofyziologií migrény. Na rozdíl od jiných neuropeptidů byl během migrény pozorován významný nárůst hladin CGRP s úlevou od bolestí hlavy po jeho návratu k normálu. Intravenózní infuze CGRP indukovala u pacientů bolest hlavy podobnou migréně.
Inhibice vlivu CGRP by mohla teoreticky snižovat kompenzační vazodilataci u ischemických stavů. Studie hodnotila účinek jednorázové intravenózní dávky 140 mg přípravku Aimovig na subjekty se stabilní anginou pectoris za podmínek kontrolované zátěže. Přípravek Aimovig vykazoval podobnou dobu trvání zátěže v porovnání s placebem a nezhoršoval u těchto pacientů ischemii myokardu.
-
Klinická účinnost a bezpečnost
Erenumab byl hodnocen jako profylaxe migrény ve dvou pivotních studiích napříč migrenózním spektrem u chronické a epizodické migrény. V obou studiích byli zařazeni pacienti s nejméně 12měsíční anamnézou migrény (s aurou nebo bez aury) podle diagnostických kritérií International Classification of Headache Disorders (ICHD-III). Starší pacienti (>65 let), pacienti nadužívající opioidy ve studii chronické migrény a rovněž pacienti s preexistujícím infarktem myokardu, cévní mozkovou příhodou, s přechodnými ischemickými atakami, nestabilní anginou pectoris, po koronárním bypassu nebo jiných revaskularizačních výkonech během 12 měsíců před screeningem se studií neúčastnili. Pacienti s nedostatečně kontrolovanou hypertenzí nebo BMI >40 byli z účasti ve studii 1 vyloučeni.
Chronická migréna
Studie 1
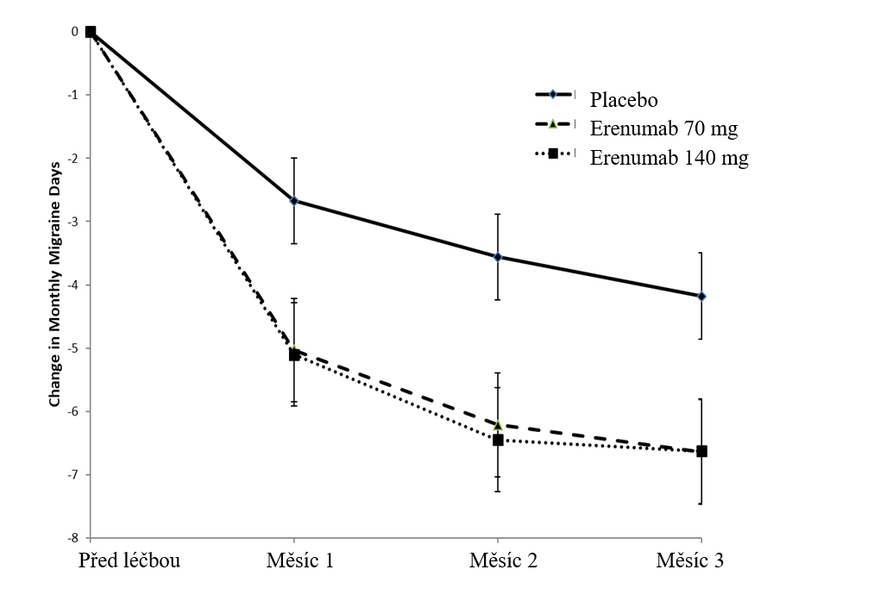
Erenumab byl hodnocen v monoterapii jako profylaxe chronické migrény v randomizované, multicentrické, 12týdenní, placebem kontrolované, dvojitě zaslepené studii u pacientů trpících migrénou s aurou nebo bez ní (≥15 dní v měsíci s bolestmi hlavy a ≥8 dní v měsíci s migrénou)Celkem 667 pacientů bylo randomizováno v poměru 3:2:2 na placebo (n = 286) nebo 70 mg (n=191) nebo 140 mg (n = 190) erenumabu, stratifikovaných podle přítomnosti nadužívání akutní úlevové medikace (přítomné u 41 % z celkového počtu pacientů). Pacientům bylo během studie povoleno užívat při bolestech hlavy úlevovou medikaci.
Demografie a charakteristika onemocnění před zahájením léčby byly vyvážené a srovnatelné mezi rameny studie. Medián věku pacientů byl 43 let, 83 % bylo žen a 94 % bílé rasy. Průměrná četnost migrény před zahájením léčby byla přibližně 18 migrenózních dní v měsíci. Celkově u 68 % selhal jeden nebo více přechozích cyklů profylaktické farmakoterapie pro nedostatek účinnosti nebo nízkou toleranci, u 49 % selhaly dva nebo více přechozích cyklů profylaktické farmakoterapie pro nedostatek účinnosti nebo nízkou toleranci. Studii dokončilo celkem 366 (96 %) pacientů v rameni s erenumabem a 265 (93 %) pacientů na placebu (tj. dokončilo hodnocení v týdnu 12).
Snížení průměrného počtu migrenózních dní v měsíci v porovnání s placebem bylo v rámci měsíční analýzy pozorováno od měsíce 1 a v následné analýze po týdnech byl nástup účinku erenumabu pozorován od prvního týdne podávání.
Obrázek 1 Změna počtu migrenózních dní v měsíci v porovnání s hodnotami před léčbou ve studii 1 (včetně primárního cílového parametru v měsíci 3)
Tabulka 2 Změna účinnosti a pacientem hlášených výsledků v týdnu 12 studie 1
Aimovig
(erenumab)
140 mg
(n = 187)Aimovig
(erenumab)
70 mg
(n = 188)Placebo
(n = 281)Léčebný rozdíl
(95% CI)p-hodnota
Hodnocení účinnosti
MMD
Průměrná změna (95% CI)
Hodnota před léčbou (SD)-6,6
(-7,5; -5,8)
17,8 (4,7)-6,6
(-7,5; -5,8)
17,9 (4,4)-4,2
(-4,9; -3,5)
18,2 (4,7)Oba -2,5
(-3,5; -1,4)Oba
<0,001≥50% MMD respondérů
Procenta [%]41,2%
39,9%
23,5%
n/a
Oba
<0,001a,d≥75% MMD respondérů
Procenta [%]20,9%
17,0%
7,8%
n/a
n/ab
Dny s akutní anti-migrenózní
medikací za měsíc
Průměrná změna
(95% CI)-4,1
(-4,7; -3,6)-3,5
(-4,0; -2,9)-1,6
(-2,1; -1,1)70 mg:
-1,9 (-2,6; -1,1)
140 mg:
-2,6 (-3,3, -1,8)Oba
<0,001aHodnoty před léčbou
(SD)9,7 (7,0)
8,8 (7,2)
9,5 (7,6)
Pacienty hlášená hodnocení
HIT-6
Průměrná změnac (95%
CI)-5,6
(-6,5; -4,6)-5,6
(-6,5; -4.6)-3,1
(-3.9; -2,3)70 mg:
-2,5 (-3,7; -1,2)
140 mg:
-2,5 (-3,7; -1,2)n/ab
MIDAS total
Průměrná změnac (95%
CI)-19,8
(-25,6; -14,0)-19,4
(-25,2; -13,6)-7,5
(-12,4; -2,7)70 mg:
-11,9 (-19,3; -4,4)
140 mg:
-12,2 (-19,7; -4.8)n/ab
CI = interval spolehlivosti; MMD = migrenózní dny v měsíci; HIT-6 = Headache Impact Test; MIDAS = Migraine Disability Assessment; n/a = neuplatňuje se
a Pro sekundární cílové parametry byly všechny p-hodnoty uvedeny jako neupravené p-hodnoty a jsou statisticky významné po úpravě pro mnohočetná srovnání.
b Pro explorativní cílové parametry není p-hodnota uvedena.
c Pro HIT-6: Změna a snížení z hodnot před léčbou byly hodnoceny během posledních 4 týdnů 12týdenní
dvojitě zaslepené léčebné fáze. Pro MIDAS: Změna a snížení z hodnot před léčbou byly hodnoceny po dobu 12 týdnů. Pro sběr dat byla použita „recall perioda“ 3 měsíce.
d p hodnota byla vypočtena na základě hodnot poměru šancíU pacientů, u nichž selhala jedna nebo více profylaktických farmakoterapií, činil rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem v redukci počtu dní migrény za měsíc MMD -3,3 dní (95% CI: -4,6; -2,1) a mezi erenumabem v dávce 70 mg a placebem -2,5 dní (95% CI: -3,8; -1,2). U pacientů, u nichž selhaly dvě nebo více přechozích profylaktických farmakoterapií, činil rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem v redukci MMD -4,3 dní (95% CI: -5,8; -2,8) a mezi erenumabem v dávce 70 mg a placebem -2,7 dní (95% CI: -4,2; -1,2). V porovnání s placebem byl ve skupině léčené erenumabem v dávce 140 mg větší podíl subjektů, které dosáhly nejméně 50% snížení MMD (40,8 % u dávky 140 mg versus 34,7 % u dávky 70 mg versus 17,3 % u placeba), s hodnotou poměru šancí 3,3 (95% CI: 2,0; 5,5) u dávky 140 mg a 2,6 (95% CI: 1,6; 4,5) u dávky 70 mg. U pacientů, u nichž selhaly dvě nebo více přechozích profylaktických farmakoterapií činil tento poměr 41,3 % u dávky 140 mg a 35,6 % u dávky 70 mg versus 14,2 % u placeba s hodnotou poměru šancí 4,2 (95% CI: 2,2; 7,9) a 3,5 (95% CI: 1,8; 6,6).
Přibližně 41 % pacientů nadužívalo úlevovou medikaci. Rozdíl v léčbě pozorovaný mezi erenumabem v dávce140 mg a placebem a mezi erenumabem v dávce 70 mg a placebem v redukci MMD činil u těchto pacientů v obou případech -3,1 dní (95% CI: -4,8; -1,4) a u redukce počtu dní s užitím akutních specifických antimigrenik činil -2,8 (95% CI: -4,2; -1,4) u dávky 140 mg a -3,3 (95% CI: -4,7; -19) u dávky 70 mg. V porovnání s placebem byl ve skupině léčené erenumabem větší podíl pacientů, kteří dosáhli nejméně 50% snížení MMD (34,6 % u dávky 140 mg, 36,4 % u dávky 70 mg versus 17,7 % u placeba), s hodnotou poměru šancí 2,5 (95% CI: 1,3; 4,9) a 2,7 (95% CI: 1,4; 5,2).
Účinnost přetrvávala až 1 rok v otevřeném rozšíření studie 1, v níž pacienti dostávali 70 mg a/nebo 140 mg erenumabu. Celkem 74,1 % pacientů dokončilo prodloužení o 52 týdnů. Při souhrnném hodnocení obou dávek bylo po 52 týdnech pozorováno snížení o 9,3 MMD v porovnání s hodnotami před léčbou v základní studii. V posledním měsíci studie dosáhlo 50 % odpovědi 59 % pacientů, kteří dokončili studii.
Epizodická migréna
Studie 2
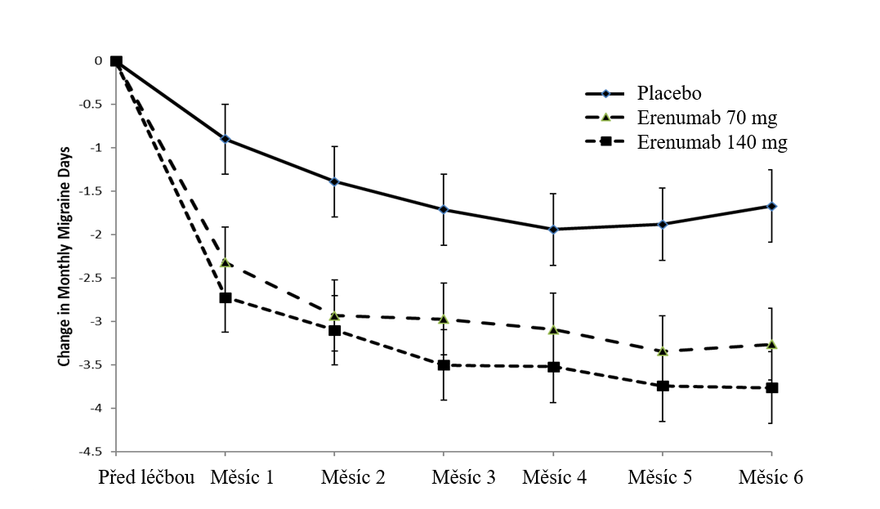
Erenumab byl hodnocen v profylaxi epizodické migrény v randomizované, multicentrické, 24týdenní, placebem kontrolované, dvojitě zaslepené studii u pacientů trpících migrénou s aurou nebo bez ní (4-14 migrenózních dnů v měsíci).Celkem 955 pacientů bylo randomizováno v poměru 1:1:1 na 140 mg (n = 319) nebo 70 mg (n = 317) erenumabu nebo placebo (n = 319). Pacientům bylo během studie povoleno užívat při bolestech hlavy úlevovou medikaci.
Demografie a charakteristika onemocnění před zahájením léčby byly vyvážené a srovnatelné mezi rameny studie. Medián věku pacientů byl 42 let, 85 % bylo žen a 89 % bílé rasy. Průměrná četnost migrény před zahájením léčby byla přibližně 8 migrenózních dní v měsíci. Celkem u 39 % selhala jedna nebo více přechozích profylaktických farmakoterapií kvůli nedostatečné účinnosti nebo špatné toleranci. Dvojitě zaslepenou fázi studie dokončilo celkem 294 (92 %) pacientů v rameni s dávkou 140 mg, 287 (91 %) pacientů s dávkou 70 mg a 284 (89 %) pacientů na placebu.
Pacienti léčení erenumabem vykazovali klinicky relevantní a statisticky významné snížení četnosti migrenózních dní v měsících 4 až 6 z hodnot před léčbou (obrázek 2) v porovnání s pacienty na placebu. Rozdíl oproti placebu byl pozorován od měsíce 1.
Obrázek 2 Změna počtu migrenózních dní v měsíci v čase v porovnání s hodnotami před léčbou ve studii 2 (včetně primárního cílového parametru v měsících 4, 5 a 6)
Tabulka 3 Změna v účinnosti a pacientem hlášených výsledků v týdnech 13–24 ve studii 2
Aimovig
(erenumab) 140 mg
(n = 318)Aimovig
(erenumab)
70 mg
(n = 312)Placebo
(n = 316)Léčebný rozdíl
(95% CI)p-hodnota
Hodnocení účinnosti
MMD
Průměrná změna
(95% CI)
Hodnota před
léčbou (SD)-3,7
(-4,0; -3,3)
8,3 (2,5)-3,2
(-3,6; -2,9)
8,3 (2,5)-1,8
(-2,2; -1,5)
8,2 (2,5)70 mg: -1,4 (-1.9; -0.9)
140 mg:-1,9 (-2,3; -1,4)Oba
<0,001a≥50% MMD
respondérů
Procenta [%]50,0 %
43,3 %
26,6 %
Obě
<0,001a,d≥75% MMD
respondérů
Procenta [%]22,0 %
20,8 %
7,9 %
n/ab
Dny s akutní anti- migrenózní medikací za měsíc
Průměrná změna
(95% CI)
Před léčbou (SD)-1,6 (-1,8;
-1,4)
3,4 (3,5)-1,1
(-1,3; -0,9)
3,2 (3,4)-0,2
(-0,4; 0,0)
3,4 (3,4)70 mg: -0,9 (-1,2; -0,6)
140 mg: -1,4 (-1,7; -1,1)Obě
<0,001aPacienty hlášená hodnocení
HIT-6
Průměrná změnac
(95% CI)-6,9
(-7,6; -6,3)-6,7
(-7,4; -6,0)-4,6
(-5,3; -4,0)70 mg: -2,1 (-3,0; -1,1)
140 mg: -2,3 (-3,2; -1,3)n/ab
MIDAS
(modifikovaný) celkem
Průměrná změnac
(95% CI)70 mg: -2,1 (-3,3; -0,9)
140 mg: -2,8 (-4,0; -1,7)n/ab
-7,5
(-8,3; -6,6)-6,7
(-7,6; -5,9)-4,6
(-5,5; -3,8)CI = interval spolehlivosti; MMD = migrenózní dny v měsíci; HIT-6 = Headache Impact Test; MIDAS = Migraine Disability Assessment; n/a = neuplatňuje se
a Pro sekundární cílové parametry byly všechny p-hodnoty uvedeny jako neupravené p-hodnoty a jsou statisticky významné po úpravě pro mnohočetná srovnání.
b Pro explorativní cílové parametry není p-hodnota uvedena.
c Pro HIT-6: Změna a snížení z hodnot před léčbou byly hodnoceny během posledních 4 týdnů 12týdenní dvojitě zaslepené léčebné fáze. Pro MIDAS: Změna a snížení z hodnot před léčbou byly hodnoceny po dobu 24 týdnů. Pro sběr dat byla použita „recall perioda“ 1 měsíc.
d p hodnota byla vypočtena na základě hodnot poměru šancí.U pacientů, u nichž selhala jedna nebo více profylaktických farmakoterapií činil rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem v redukci MMD -2,5 dne (95% CI: -3,4; -1,7) a erenumabem v dávce 70 mg a placebem -2,0 dny (95% CI: -2,8; -1,2). V porovnání s placebem byl ve skupině léčené erenumabem větší podíl subjektů, které dosáhly nejméně 50 % snížení MMD (39,7 % u dávky 140 mg a 38,6 % u dávky 70 mg, s hodnotou poměru šancí 3,1 [95% CI: 1,7; 5,5] u dávky 140 mg a 2,9 [95% CI: 1,6; 5,3]).
Účinnost v aktivní opětovné randomizační fázi studie 2 přetrvávala až 1 rok. Pacienti byli opětovné randomizováni do aktivní léčebné fáze (ATP) s dávkou 70 mg nebo 140 mg erenumabu. Celou studii v délce 52 týdnů dokončilo 79,8 % pacientů. Snížení počtu migrenózních dní v měsíci z hodnot před léčbou v týdnu bylo -4,22 dní v ATP skupině s dávkou 70 mg a -4,64 dní v ATP skupině s dávkou 140 mg. V týdnu 52 byl podíl subjektů, které dosáhly ≥50 % snížení MMD z hodnot před léčbou, 61,0 % v ATP skupině s dávkou 70 mg a 64,9 % v ATP skupině s dávkou 140 mg.
Dlouhodobá následná studie
Po placebem kontrolované studii pokračovalo v otevřené léčebné fázi po dobu 5 let 383 pacientů, kteří zpočátku dostávali 70 mg erenumabu (medián expozice: 2,0 roky), z nichž 250 pacientů zvýšilo svoji dávku na 140 mg (medián expozice: 2,7 let). Celkem 214 pacientů dokončilo otevřenou fázi léčby v délce 5 let. Z 383 pacientů přerušilo léčbu 168 (43,9 %), přičemž nejčastějšími důvody byly žádost pacienta (84 pacientů; 21,9 %), nežádoucí účinky (19 pacientů; 5,0 %), ztracení při následném sledování (14 pacientů; 3,7 %) a nedostatečná účinnost (12 pacientů; 3,1 %). Výsledky naznačují, že v otevřené léčebné fázi studie účinnost přetrvávala po dobu až 5 let.Studie 3: Studie u pacientů s předchozím selháním nebo nevhodností 2 až 4 profylaktických farmakoterapií migrény
Celkem 246 dospělých pacientů s epizodickou migrénou bylo randomizováno v poměru 1:1 do skupin léčených buď erenumabem 140 mg (n = 121) nebo placebem (n = 125) po dobu 12 týdnů. Tři pacienti (erenumab: 2; placebo: 1) byli vyloučeni z primární analýzy, protože jim nebyla podávána studijní léčba. Během posledních 4 týdnů dvojitě zaslepené léčby dosáhlo 30,3 % (36/119) pacientů ve skupině s erenumabem alespoň 50% snížení MMD oproti výchozí hodnotě ve srovnání s 13,7 % (17/124) ve skupině s placebem (p = 0,002).Studie 4: Studie k posouzení snášenlivosti (primární cílový parametr) a účinnosti oproti topiramátu
Celkem 777 dospělých pacientů s epizodickou nebo chronickou migrénou bylo randomizováno v poměru 1:1 do skupin léčených buď erenumabem (70 mg nebo 140 mg; n = 389) nebo topiramátem 50 až 100 mg (n = 388) po dobu 24 týdnů (dvojitě zaslepená léčebná fáze). Údaje o bezpečnosti a účinnosti byly shromážděny pro pacienty užívající erenumab v dávkách 70 mg a 140 mg a porovnány s údaji pro pacienty užívající topiramát.Erenumab prokázal lepší snášenlivost oproti topiramátu na základě četnosti přerušení léčby z důvodu nežádoucích účinků (erenumab: 10,5 %; topiramát: 38,9 %; p < 0,001; primární cílový parametr). Navíc 55,4 % pacientů ve skupině s erenumabem dosáhlo alespoň 50% snížení MMD oproti výchozí hodnotě během posledních 3 měsíců studie ve srovnání s 31,2 % ve skupině s topiramátem (p < 0,001).
-
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Aimovig v prevenci migrenózních bolestí hlavy u jedné nebo více podskupin pediatrické populace (informace o použití u pediatrické populace viz bod 4.2).
-
-
5.2 Farmakokinetické vlastnosti
Erenumab vykazuje nelineární kinetiku jako důsledek vazby na CGRP-R receptor. Nicméně v odpovídajících terapeutických dávkách po subkutánním podání každé 4 týdny je vzhledemk saturaci vazby na CGRP-R farmakokinetika erenumabu převážně lineární. Subkutánní podání dávky 140 mg jednou měsíčně a podání dávky 70 mg jednou měsíčně zdravým dobrovolníkům znamenalo průměrné Cmax (směrodatná odchylka [SD]) 15,8 (4,8) µg/ml a 6,1 (2,1) µg/ml, a průměrné AUClast (SD) 505 (139) den*µg/ml a 159 (58) den*µg/ml.
Po podání dávky 140 mg každé 4 týdny byla pozorována méně než 2násobná kumulace údolní sérové koncentrace a ustálenému stavu se údolní sérová koncentrace přiblížila během 12 týdnů léčby.
-
Absorpce
Po jednorázové subkutánní dávce 140 mg nebo 70 mg erenumabu podané zdravým dospělým bylo mediánu nejvyšší koncentrace dosaženo během 4–6 dní a odhadovaná absolutní biologická dostupnost činila 82 %.
-
Distribuce
Po jednorázové 140mg intravenózní dávce byl průměrný distribuční objem (SD) během terminální fáze (Vz) odhadován na 3,86 (0,7) l.
-
Biotransformace / Eliminace
U erenumabu byly pozorovány dvě eliminační fáze. Při nízkých koncentracích probíhá eliminace převážně přes saturační vazbu na cíl (CGRP-R), zatímco při vyšších koncentracích je erenumab z velké části eliminován nespecifickou proteolytickou cestou. Během doby podávání je erenumab převážně eliminován nespecifickou proteolytickou cestou s efektivním poločasem 28 dní.
-
Zvláštní populace
Pacienti s poruchou funkce ledvin
Pacienti s těžkou poruchou funkce ledvin (eGFR <30 ml/min/1,73 m2) nebyli studováni. Populační farmakokinetická analýza integrovaných dat z klinických studií s přípravkem Aimovig neodhalila rozdíly ve farmakokinetice erenumabu u pacientů s lehkou až středně těžkou poruchou funkce v porovnání s pacienty s normální funkcí ledvin (viz bod 4.2).Pacienti s poruchou funkce jater
U pacientů s poruchou funkce jater nebyly provedeny žádné studie. Erenumab jako humánní monoklonální protilátka není metabolizován enzymy cytochromu P450 a hepatální clearance není pro erenumab převažující metabolickou cestou (viz bod 4.2).
-
-
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Studie kancerogenity nebyly s erenumabem provedeny. Erenumab není farmakologicky aktivní u hlodavců. Vykazuje biologickou aktivitu u opic Cynomolgus, nicméně tento druh není vhodným modelem pro hodnocení tumorogenního rizika. Mutagenní potenciál erenumabu nebyl hodnocen; nicméně u monoklonálních protilátek se nepředpokládá vliv na DNA nebo chromozomy.
V toxikologických studiích s opakovanými dávkami nebyly u pohlavně zralých opic pozorovány nežádoucí účinky po dávkách do 150 mg/kg podávaných subkutánně dvakrát týdně po dobu až 6 měsíců při systémových expozicích až do 123násobku a 246násobku klinické dávky 140 mg a 70 mg podané každé 4 týdny, hodnoceno podle sérového AUC. V těchto studiích rovněž nebyly pozorovány nežádoucí účinky na náhradní markery fertility (anatomicko patologické nebo histopatologické změny reprodukčních orgánů).
V reprodukčních studiích u opic Cynomolgus nebyl pozorován vliv na březost, embryofetální nebo postnatální vývoj (až do 6 měsíců věku), pokud byl erenumab podáván během březosti v expozičních hladinách přibližně 17krát a 34krát vyšších než u pacientů léčených erenumabem v dávce 140 mg a 70 mg každé 4 týdny, hodnocené podle AUC. U mláďat opic po porodu byly v séru nalezeny měřitelné koncentrace erenumabu, což potvrzuje skutečnost, že erenumab, podobně jako jiné IgG protilátky, prochází placentární bariérou.
6. FARMACEUTICKÉ ÚDAJE
-
6.1 Seznam pomocných látek
Sacharóza
Polysorbát 80
Hydroxid sodný (k úpravě pH)
Ledová kyselina octová
Voda pro injekci
-
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
-
6.3 Doba použitelnosti
3 roky
-
6.4 Zvláštní opatření pro uchovávání
-
Předplněná injekční stříkačka
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte předplněné injekční stříkačky v krabičce, aby byl přípravek chráněn před světlem.
Po vyjmutí z chladničky musí být přípravek Aimovig použit během 7 dní, pokud bude uchováván při pokojové teplotě (do 25 °C), nebo znehodnocen. Pokud je uchováván při vyšší teplotě nebo po delší dobu, musí být znehodnocen.
-
Předplněné pero
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte předplněná pera v krabičce, aby byl přípravek chráněn před světlem.
Po vyjmutí z chladničky musí být přípravek Aimovig použit během 7 dní, pokud bude uchováván při pokojové teplotě (do 25 °C), nebo znehodnocen. Pokud je uchováván při vyšší teplotě nebo po delší dobu, musí být znehodnocen.
-
-
6.5 Druh obalu a obsah balení
-
Předplněná injekční stříkačka
Přípravek Aimovig je dodáván v předplněné injekční stříkačce (1 ml, sklo třídy 1) s jehlou z nerezové oceli a krytem jehly (pryž obsahující latex).
Přípravek Aimovig je dostupný v balení obsahujícím 1 předplněnou injekční stříkačku.
-
Předplněné pero
Přípravek Aimovig je dodáván v předplněném peru (1 ml, sklo třídy 1) s jehlou z nerezové oceli a krytem jehly (pryž obsahující latex).
Přípravek Aimovig je dostupný v balení obsahujícím 1 předplněné pero a vícečetném balení obsahujícím 3 (3x1) předplněná pera.
Na trhu nemusí být všechny velikosti balení.
-
-
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před podáním je nutné roztok vizuálně zkontrolovat. Roztok nesmí být aplikován, pokud je zakalený, zřetelně žlutý nebo obsahuje vločky nebo částice.
-
Předplněná injekční stříkačka
K zabránění diskomfortu v místě injekce je nutné před podáním injekce ponechat předplněnou injekční stříkačku při pokojové teplotě (do 25 °C) po dobu nejméně 30 minut. Je nutné ji též chránit před přímým slunečním světlem. Musí být injikován celý obsah předplněné injekční stříkačky.
Stříkačka nesmí být zahřívána zdrojem tepla jako horká voda nebo v mikrovlnné troubě a obsah se nesmí protřepávat.
-
Předplněné pero
K zabránění diskomfortu v místě injekce je nutné před podáním injekce ponechat předplněné pero při pokojové teplotě (do 25 °C) po dobu nejméně 30 minut. Je nutné ho též chránit před přímým slunečním světlem. Musí být injikován celý obsah předplněného pera. Pero nesmí být zahříváno zdrojem tepla jako horká voda nebo v mikrovlnné troubě a obsah se nesmí protřepávat.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
-
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irsko
8. REGISTRAČNÍ ČÍSLO/REGISTRAČNÍ ČÍSLA
EU/1/18/1293/001-006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 26. července 2018
Datum posledního prodloužení registrace: 20. února 2023
10. DATUM REVIZE TEXTU
15. června 2023
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Zkrácená informace o přípravku v pdf →
