SPC Leqvio [1]
Souhrn údajů o přípravku LEQVIO
▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Leqvio 284 mg injekční roztok v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna předplněná injekční stříkačka obsahuje inclisiranum natricum odpovídající inclisiranum 284 mg v 1,5 ml roztoku.
Jeden ml obsahuje inclisiranum natricum odpovídající inclisiranum 189 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce).
Roztok je čirý, bezbarvý až světle žlutý a prakticky prostý částic.
4. KLINICKÉ ÚDAJE
-
4.1 Terapeutické indikace
Přípravek Leqvio je indikován u dospělých s primární hypercholesterolemií (heterozygotní familiární a nefamiliární) nebo smíšenou dyslipidemií jako doplněk k dietním opatřením:
- v kombinaci se statinem nebo statinem v kombinaci s jinými přípravky snižujícími hladinu lipidů u pacientů neschopných dosáhnout cílů pro LDL-C při maximální tolerované dávce statinu, nebo
- samostatně nebo v kombinaci s jinými přípravky snižujícími hladinu lipidů u pacientů trpících nesnášenlivostí statinu nebo u nichž je statin kontraindikován.
-
4.2 Dávkování a způsob podání
-
Dávkování
Doporučená dávka je 284 mg inklisiranu podávaná jako jednorázová subkutánní injekce: počáteční dávka, další po
3 měsících a poté každých 6 měsíců.Vynechané dávky
Pokud je plánovaná dávka opožděna o méně než 3 měsíce, má být inklisiran podán a dávkování má pokračovat podle pacientova původního schématu.Pokud je plánovaná dávka opožděna o více než 3 měsíce, má být zahájen nový dávkovací režim – má být podána počáteční dávka inklisiranu, další po 3 měsících a poté každých 6 měsíců.
Přechod z léčby monoklonálními protilátkami inhibujícími PCSK9
Inklisiran lze podávat okamžitě po poslední dávce monoklonální protilátky inhibující PCSK9. Pro udržení snížení LDL-C se doporučuje, aby byl inklisiran podán do 2 týdnů po poslední dávce monoklonální protilátky inhibující PCSK9.Zvláštní populace
Starší osoby (věk ≥65 let)
U starších pacientů není nutná úprava dávky.Porucha funkce jater
U pacientů s lehkou (ChildPugh třída A) nebo středně těžkou poruchou funkce jater (ChildPugh třída B) není nutná úprava dávky. U pacientů s těžkou poruchou funkce jater (ChildPugh třída C) nejsou k dispozici žádné údaje
(viz bod 5.2). Inklisiran má být používán s opatrností u pacientů s těžkou poruchou funkce jater.Porucha funkce ledvin
U pacientů s lehkou, středně těžkou nebo těžkou poruchou funkce ledvin nebo u pacientů v konečném stádiu onemocnění ledvin není nutná úprava dávky (viz bod 5.2). Zkušenosti s inklisiranem u pacientů s těžkou poruchou funkce ledvin jsou omezené. Inklisiran má být u těchto pacientů používán s opatrností. Viz bod 4.4, kde jsou uvedena preventivní opatření v případě hemodialýzy.Pediatrická populace
Bezpečnost a účinnost inklisiranu u dětí ve věku do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
-
Způsob podání
Subkutánní podání.
Inklisiran je určen pro subkutánní injekci do břicha; alternativní místa vpichu zahrnují paži nebo stehno. Injekce nemají být podávány do oblastí aktivního kožního onemocnění nebo poranění, jako jsou spáleniny od slunce, kožní vyrážky, zánět nebo kožní infekce.
Každá dávka 284 mg se podává pomocí jedné předplněné stříkačky. Každá předplněná injekční stříkačka je pouze pro jedno použití.
Inklisiran je určen pro podání zdravotnickým pracovníkem.
-
-
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
-
4.4 Zvláštní upozornění a opatření pro použití
-
Hemodialýza
Účinek hemodialýzy na farmakokinetiku inklisiranu nebyl studován. Vzhledem k tomu, že inklisiran je vylučován ledvinami, nemá se hemodialýza provádět po dobu nejméně 72 hodin od podání inklisiranu.
-
Obsah sodíku
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, to znamená, že je v podstatě „bez sodíku“.
-
-
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Inklisiran není substrátem pro běžné transportéry léčiv, a přestože nebyly provedeny studie in vitro, nepředpokládá se, že bude substrátem pro cytochrom P450. Inklisiran není inhibitorem nebo induktorem enzymů cytochromu P450 nebo běžných transportérů léčiv. Proto se neočekává, že by inklisiran měl klinicky významné interakce s jinými léčivými přípravky. Na základě omezených dostupných údajů nejsou očekávány klinicky významné interakce s atorvastatinem, rosuvastatinem nebo jinými statiny.
-
4.6 Fertilita, těhotenství a kojení
-
Těhotenství
Údaje o podávání inklisiranu těhotným ženám jsou omezené nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3). Podávání inklisiranu v těhotenství se z preventivních důvodů nedoporučuje.
-
Kojení
Není známo, zda se inklisiran vylučuje do lidského mateřského mléka. Dostupné farmakodynamické/toxikologické údaje u zvířat prokázaly vylučování inklisiranu do mléka (viz bod 5.3). Riziko pro kojené novorozence/děti nelze vyloučit.
Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání inklisiranu.
-
Fertilita
Údaje o účinku inklisiranu na lidskou plodnost nejsou k dispozici. Studie na zvířatech žádné účinky na fertilitu neprokázaly (viz bod 5.3).
-
-
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Leqvio nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
-
4.8 Nežádoucí účinky
-
Souhrn bezpečnostního profilu
Jedinými nežádoucími účinky spojenými s inklisiranem byly nežádoucí účinky v místě vpichu (8,2 %).
-
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky jsou řazeny podle tříd orgánových systémů (tabulka 1). Kategorie četnosti jsou jako: velmi časté (≥1/10), časté (≥1/100 až <1/10), méně časté (≥1/1000 až <1/100), vzácné (≥1/10000 až <1/1000), velmi vzácné (<1/10000) a není známo (z dostupných údajů nelze určit).
Tabulka 1 Nežádoucí účinky hlášené u pacientů léčených inklisiranem
Třídy orgánových systémů Nežádoucí účinek Kategorie četnosti Celkové poruchy a reakce v místě aplikace Reakce v místě vpichu1 Časté 1 viz bod “Popis vybraných nežádoucích účinků”
-
Popis vybraných nežádoucích účinků
Nežádoucí účinky v místě injekce
Ve stěžejních studiích se vyskytly nežádoucí účinky v místě vpichu u 8,2 % pacientů léčených inklisiranem a u 1,8 % pacientů na placebu. Podíl pacientů v každé skupině, kteří přerušili léčbu z důvodu nežádoucích účinků v místě vpichu, byl 0,2 %, respektive 0,0 %. Všechny tyto nežádoucí účinky byly mírné nebo středně závažné, přechodné a vymizely bez následků. Nejčastěji se vyskytujícími nežádoucími účinky v místě vpichu u pacientů léčených inklisiranem byly reakce v místě vpichu (3,1 %), bolest v místě vpichu (2,2 %), erytém v místě vpichu (1,6 %) a vyrážka v místě vpichu (0,7 %).
-
Zvláštní populace
Starší osoby
Z 1833 pacientů léčených inklisranem ve stěžejních studiích bylo 981 (54 %) ve věku 65 let nebo starších, zatímco 239 (13 %) bylo ve věku 75 let nebo starších. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné rozdíly v bezpečnosti.
-
Imunogenita
Ve stěžejních studiích bylo testováno na protilátky proti přípravku 1830 pacientů. Potvrzená pozitivita byla detekována u 1,8 % (33/1830) pacientů před podáním a u 4,9 % (90/1830) pacientů během 18 měsíců léčby inklisiranem. U pacientů, kteří byli pozitivně testováni na protilátky proti inklisiranu, nebyly pozorovány žádné klinicky významné rozdíly v klinické účinnosti, bezpečnosti nebo farmakodynamických profilech inklisiranu.
-
Laboratorní hodnoty
V klinických studiích fáze III došlo u pacientů užívajících inklisiran častěji ke zvýšení hodnot jaterních transamináz v séru v rozmezí >1x horní hranicí normálu (ULN) a ≤3x ULN (ALT: 19,7 % a AST: 17,2 %) než u pacientů na placebu (ALT: 13,6 % a AST: 11,1 %). Tato zvýšení nepřekročila klinicky relevantní prahovou hodnotu 3x ULN, byla asymptomatická a nebyla spojena s nežádoucími účinky nebo jinými známkami dysfunkce jater.
-
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky přímo na níže uvedenou adresu.
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: nezadouciucinky.sukl.cz [2]
-
-
4.9 Předávkování
U zdravých dobrovolníků, kteří dostávali inklisiran v dávkách až do trojnásobku terapeutické dávky, nebyly pozorovány žádné klinicky relevantní nežádoucí účinky. Pro předávkování inklisiranem není k dispozici žádná zvláštní léčba. V případě předávkování má být pacient léčen symptomaticky a podle potřeby mají být zavedena podpůrná opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
-
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: látky upravující hladinu lipidů, jiné látky upravující hladinu lipidů, ATC kód: C10AX16
-
Mechanizmus účinku
Inklisiran je dvouvláknová, malá interferující RNA (siRNA) snižující cholesterol, konjugovaná na sense vláknu s triantenárním N-acetylgalaktosaminem (GalNAc) pro usnadnění absorpce hepatocyty. V hepatocytech inklisiran využívá interferenční mechanismus RNA a řídí katalytické štěpení mRNA pro proprotein konvertázu subtilisin kexin typu 9. To zvyšuje recyklaci a expresi LDL-C receptoru na buněčném povrchu hepatocytů, což zvyšuje vychytávání LDL-C a snižuje hladiny LDL-C v oběhu.
-
Farmakodynamické účinky
Po jednorázovém subkutánním podání 284 mg inklisiranu bylo snížení LDL-C zjevné během 14 dnů od podání dávky. Průměrné snížení o 4951 % pro LDL-C bylo pozorováno 30 až 60 dní po podání dávky. V den 180 byly hladiny LDL-C stále sníženy přibližně o 53 %.
-
Klinická účinnost a bezpečnost
V klinických studiích a v některých publikacích se dávka 284 mg inklisiranu uvádí jako ekvivalentní a popisovaná jako 300 mg sodné soli inklisiranu.
Účinnost inklisiranu byla hodnocena ve třech studiích fáze III u pacientů s aterosklerotickým kardiovaskulárním onemocněním (ASCVD - atherosclerotic cardiovascular disease) (ischemická choroba srdeční, cerebrovaskulární onemocnění nebo onemocnění periferních tepen), ekvivalenty rizika ASCVD (diabetes mellitus 2. typu, familiární hypercholesterolémie nebo 10leté riziko 20 % nebo více kardiovaskulární příhody hodnoceno podle Framinghamského skóre rizika nebo ekvivalentu) a/nebo familiární hypercholesterolémie (FH). Pacienti užívali maximálně tolerovanou dávku statinu s nebo bez jiného přípravku modifikujícího lipidy a vyžadovali další snížení LDL-C (pacienti neschopní dosáhnout svých léčebných cílů). Přibližně 17 % pacientů trpělo intolerancí na statiny. Pacientům byly podávány subkutánní injekce 284 mg inklisiranu nebo placeba v den 1, den 90, den 270 a den 450. Pacienti byli sledováni až do dne 540.
Účinek inklisiranu na kardiovaskulární nemocnost a úmrtnost nebyl dosud stanoven.
Ve společné analýze fáze III subkutánně podávaný inklisiran snížil LDL-C o 50 % a 55 % již v den 90 (obrázek 1), léčebný efekt přetrval během dlouhodobé terapie. Maximálního snížení LDL-C bylo dosaženo v den 150 po druhém podání. Malá, ale statisticky významná větší snížení LDL-C až o 65 % byla spojena s nižšími výchozími hladinami LDL-C (přibližně <2 mmol/l [77 mg/dl]), vyššími výchozími hladinami PCSK9 a vyššími dávkami statinu a intenzitou statinu.
Obrázek 1 Průměrná procentuální změna výchozí hodnoty LDL-C u pacientů s primární hypercholesterolémií a smíšenou dyslipidémií léčených inklisiranem v porovnání s placebem (společná analýza)
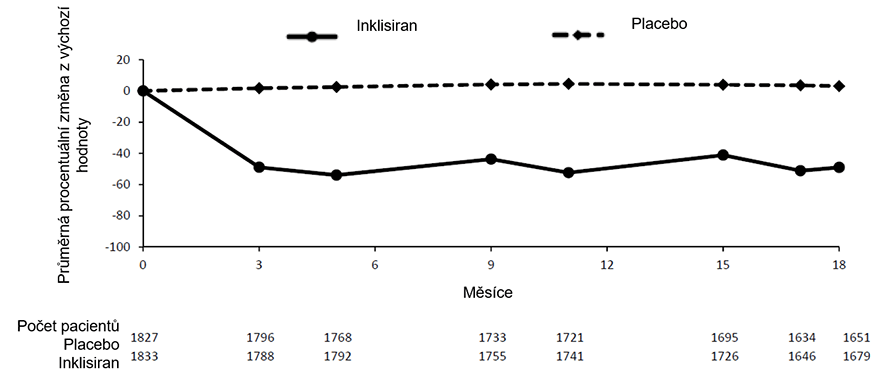
Rizikové ekvivalenty ASCVD a ASCVD
Byly provedeny dvě studie u pacientů s rizikovými ekvivalenty ASCVD a ASCVD (ORION-10 a ORION-11). Pacienti užívali maximálně tolerovanou dávku statinů s nebo bez jiného přípravku modifikujícího lipidy, jako je ezetimib, a vyžadovali další snížení LDL-C. Protože se očekává, že snížení LDL-C zlepší kardiovaskulární výsledky, ko-primárními cílovými parametry v každé studii byla procentuální změna LDL-C od výchozí hodnoty do dne 510 v porovnání s placebem a časově upravená procentuální změna LDL-C od výchozí hodnoty po dni 90 až do dne 540 pro odhad integrovaného účinku na LDL-C v průběhu času.ORION-10 byla multicentrická, dvojitě slepá, randomizovaná, placebem kontrolovaná 18měsíční studie prováděná u 1561 pacientů s ASCVD.
Průměrný věk na začátku studie byl 66 let (rozmezí 35 až 90 let), 60 % bylo ve věku ≥65 let, 31 % byly ženy, 86 % bylo bílé, 13 % černé, 1 % asijské a 14 % hispánské nebo latinské etnikum. Průměrná výchozí hodnota LDL-C byla 2,7 mmol/l (105 mg/dl). Šedesát devět procent (69 %) užívalo statiny vysoké intenzity, 19 % užívalo statiny střední intenzity, 1 % užívalo statiny nízké intenzity a 11 % neužívalo statiny. Nejčastěji podávanými statiny byly atorvastatin a rosuvastatin.
Inklisiran významně snížil průměrnou procentuální změnu LDL-C od výchozí hodnoty do dne 510 v porovnání s placebem o 52 % (95% CI: 56 %, 49 %; p <0,0001) (tabulka 2).
Inklisiran také významně snížil časově upravenou procentuální změnu LDL-C od výchozí hodnoty po dni 90 a do dne 540 o 54 % ve srovnání s placebem (95% CI: 56 %, 51 %; p <0,0001). Další výsledky viz tabulka 2.
Tabulka 2 Průměrná procentuální změna z výchozí hodnoty a rozdíl od placeba u lipidových parametrů v den 510 ve studii ORION10
Léčebná skupina LDLC Celkový cholesterol NonHDLC ApoB Lp(a)* Průměrná výchozí hodnota v mg/dl** 105 181 134 94 122 Den 510 (průměrná procentuální změna z výchozí hodnoty) Placebo (n=780) 1 0 0 2 4 Inklisiran (n=781) 51 34 47 45 22 Rozdíl od placeba (průměr nejmenších čtverců)
(95% CI)52
(56, 49)33
(35, 31)47
(50, 44)43
(46, 41)26
(29, 22)*Den 540; medián procentuální změny hodnot Lp(a)
**Průměrná výchozí hodnota Lp(a) v mmol/lV den 510 bylo dosaženo cíle LDL-C <1,8 mmol/l (70 mg/dl) u 84 % pacientů s ASCVD léčených inklisiranem v porovnání s 18 % pacientů s ASCVD na placebu.
Konzistentní a statisticky významné (p <0,0001) snížení procentuální změny v LDL-C ze základní hodnoty do dne 510 a časově upravené procentuální změny v LDL-C ze základní hodnoty po dni 90 a až do dne 540 byly pozorovány ve všech podskupinách bez ohledu na základní demografické údaje, základní charakteristiky onemocnění (včetně pohlaví, věku, indexu tělesné hmotnosti, rasy a použití výchozího statinu), komorbidit a geografických oblastí.
ORION-11 byla mezinárodní, multicentrická, dvojitě slepá, randomizovaná, placebem kontrolovaná 18měsíční studie, která hodnotila 1617 pacientů s rizikovými ekvivalenty ASCVD nebo ASCVD. Více než 75 % pacientů bylo současně léčeno statiny s vysokou intenzitou, 87 % pacientů mělo ASCVD a 13 % bylo ekvivalentních rizik ASCVD.
Průměrný věk na začátku studie byl 65 let (rozmezí: 20 až 88 let), 55 % bylo ve věku ≥65 let, 28 % byly ženy, 98 % byl0 bílé, 1 % černé, 1 % asijské a 1 % hispánské nebo latinské etnikum. Průměrná výchozí hodnota LDL-C byla 2,7 mmol/l (105 mg/dl). Sedmdesát osm procent (78 %) užívalo statiny s vysoké intenzity, 16 % užívalo statiny střední intenzity, 0,4 % užívalo statiny s nízké intenzity a 5 % statiny neužívalo. Nejčastěji podávanými statiny byly atorvastatin a rosuvastatin.
Inklisiran významně snížil průměrnou procentuální změnu LDL-C od výchozí hodnoty do dne 510 v porovnání s placebem o 50 % (95% CI: 53 %, 47 %; p <0,0001) (tabulka 3).
Inklisiran také významně snížil časově upravenou procentuální změnu LDL-C od základní hodnoty po dni 90 a do dne 540 o 49 % v porovnání s placebem (95% CI: 52 %, 47 %; p <0,0001). Další výsledky viz tabulka 3.
Tabulka 3 Průměrná procentuální změna oproti výchozím hodnotám a rozdíl v lipidových parametrech v porovnání s placebem v den 510 ve studii ORION-11
Léčebná skupina LDLC Celkový cholesterol NonHDLC ApoB Lp(a)* Průměrná výchozí hodnota v mg/dl** 105 185 136 96 107 Den 510 (průměrná procentuální změna z výchozí hodnoty) Placebo (n=807) 4 2 2 1 0 Inklisiran (n=810) 46 28 41 38 19 Rozdíl od placeba (průměr nejmenších čtverců)
(95% CI)50
(53, 47)30
(32, 28)43
(46, 41)39
(41, 37)19
(21, 16)*Den 540; medián procentuální změny hodnot Lp(a)
**Průměrná výchozí hodnota Lp(a) v mmol/lV den 510 bylo dosaženo cíle LDL-C <1,8 mmol/l (70 mg/dl) 82 % pacientů s ASCVD léčených inklisiranem v porovnání se 16 % pacientů s ASCVD na placebu. U pacientů s rizikovým ekvivalentem ASCVD bylo dosaženo cíle LDL-C <2,6 mmol/l (100 mg/dl) u 78 % pacientů léčených inklisiranem v porovnání s 31 % pacientů na placebu.
Konzistentní a statisticky významná (p <0,05) procentuální změna v LDL-C od výchozí hodnoty do dne 510 a časově upravená procentuální změna v LDL-C od základní hodnoty po dni 90 a až do dne 540 byla pozorována ve všech podskupinách bez ohledu na základní demografické údaje, základní charakteristiky onemocnění (včetně pohlaví, věku, indexu tělesné hmotnosti, rasy a použití výchozího statinu), komorbidit a geografických oblastí.
Heterozygotní familiární hypercholesterolémie
ORION-9 byla mezinárodní, multicentrická, dvojitě slepá, randomizovaná, placebem kontrolovaná 18měsíční studie u 482 pacientů s heterozygotní familiární hypercholesterolémií (HeFH). Všichni pacienti užívali maximálně tolerované dávky statinů s nebo bez jiné terapie modifikující lipidy, jako je ezetimib, a vyžadovali další snížení LDL-C. Diagnóza HeFH byla stanovena buď genotypizací nebo klinickými kritérii („definitivní FH“ s použitím kritérií Simon Broome nebo WHO/Dutch Lipid Network).
Společnými primárními cílovými parametry byla procentuální změna LDL-C od výchozí hodnoty do dne 510 v porovnání s placebem a časově upravená procentuální změna v LDL-C od výchozí hodnoty po dni 90 a až do dne 540 pro odhad integrovaného účinku na LDL-C v průběhu času. Klíčovými sekundárními cílovými parametry byly absolutní změna
LDL-C od výchozí hodnoty do dne 510, časově upravená absolutní změna LDL-C od výchozí hodnoty po dni 90 a až do dne 540 a procentuální změna od výchozí hodnoty do dne 510 v PCSK9, celkový cholesterol, Apo B a non-HDL-C. Mezi další sekundární cílové ukazatele patřily individuální citlivost na inklisiran a podíl pacientů dosahujících globálních lipidových cílů pro jejich úroveň rizika ASCVD.Průměrný věk na začátku studie byl 55 let (rozmezí: 21 až 80 let), 22 % bylo ve věku ≥65 let, 53% byly ženy, 94 % bylo bílé, 3 % černé, 3 % asijské a 3 % hispánské nebo latinské etnikum. Průměrná výchozí hodnota LDL-C byla 4,0 mmol/l (153 mg/dl). Sedmdesát čtyři procent (74 %) užívalo statiny vysoké intenzity, 15 % užívalo statiny střední intenzity a 10 % statiny neužívalo. Padesát dvě procenta (52 %) pacientů bylo léčeno ezetimibem. Nejčastěji podávanými statiny byly atorvastatin a rosuvastatin.
Inklisiran významně snížil průměrnou procentuální změnu LDL-C od výchozí hodnoty do dne 510 ve srovnání s placebem o 48 % (95% CI: -54 %, -42 %; p <0,0001) (tabulka 4).
Inklisiran také významně snížil časově upravenou procentuální změnu LDL-C od výchozí hodnoty po dni 90 a do dne 540 o 44% v porovnání s placebem (95% CI: 48 %, 40 %; p<0.0001). Další výsledky viz tabulka 4.
Tabulka 4 Průměrná procentuální změna oproti výchozím hodnotám a rozdíl v lipidových parametrech v porovnání s placebem v den 510 ve studii ORION-9
Léčebná skupina LDLC Celkový cholesterol NonHDLC ApoB Lp(a)* Průměrná výchozí hodnota v mg/dl** 153 231 180 124 121 Den 510 (průměrná procentuální změna z výchozí hodnoty) Placebo (n=240) 8 7 7 3 4 Inklisiran (n=242) 40 25 35 33 13 Rozdíl od placeba (průměr nejmenších čtverců)
(95% CI)48
(54, 42)32
(36, 28)42
(47, 37)36
(40, 32)17
(22, 12)*Den 540; medián procentuální změny hodnot Lp(a)
**Průměrná výchozí hodnota Lp(a) v mmol/lV den 510 dosáhlo 52,5 % pacientů s ASCVD léčených inklisiranem svého cíle LDL-C <1,8 mmol l (70 mg/dl) v porovnání se 1,4 % pacientů s ASCVD na placebu, zatímco ve skupině s ASCVD rizikovými ekvivalenty 66,9 % pacientů léčených inklisiranem dosáhlo svého cíle LDL-C <2,6 mmol/l (100 mg/dl) v porovnání s 8,9 % pacientů na placebu.
Konzistentní a statisticky významná (p <0,05) procentuální změna v LDL-C od výchozí hodnoty do dne 510 a časově upravená procentuální změna v LDL-C od výchozí hodnoty po dni 90 a až do dne 540 byly pozorovány ve všech podskupinách bez ohledu na základní demografické údaje, základní charakteristiky onemocnění (včetně pohlaví, věku, indexu tělesné hmotnosti, rasy a použití výchozího statinu), komorbidit a geografických oblastí.
-
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s inklisiranem u jedné nebo více podskupin pediatrické populace ve schválené indikaci léčba zvýšeného cholesterolu (informace o použití u dětí viz bod 4.2).
-
-
5.2 Farmakokinetické vlastnosti
-
Absorpce
Po jednorázovém subkutánním podání vzrostla systémová expozice inklisiranu přibližně úměrně dávce v rozmezí od 24 mg do 756 mg. Při doporučeném dávkovacím režimu 284 mg dosáhly plazmatické koncentrace vrcholu přibližně za 4 hodiny po podání dávky, se střední hodnotou Cmax 509 ng/ml. Koncentrace dosáhly nezjistitelných hladin během 48 hodin po podání. Průměrná plocha pod křivkou závislosti plazmatické koncentrace od času extrapolovaného do nekonečna byla 7980 ng*h/ml. Farmakokinetické nálezy po opakovaném subkutánním podání inklisiranu byly podobné jako po podání jedné dávky.
-
Distribuce
Inklisiran se in vitro v relevantních klinických plazmatických koncentracích z 87 % váže na proteiny. Po jednorázové subkutánní dávce 284 mg inklisiranu zdravým dospělým je zdánlivý distribuční objem přibližně 500 litrů. Na základě neklinických údajů bylo prokázáno, že inklisiran má selektivitu pro játra a je vysoce vychytáván játry, což je cílový orgán pro snižování cholesterolu.
-
Biotransformace
Inklisiran je primárně metabolizován nukleázami na kratší neaktivní nukleotidy různé délky. Inklisiran není substrátem pro běžné transportéry léčiv, a přestože nebyly provedeny studie in vitro, nepředpokládá se, že bude substrátem pro cytochrom P450.
-
Eliminace
Terminální poločas eliminace inklisiranu je přibližně 9 hodin a při opakovaném dávkování nedochází k žádné akumulaci. Šestnáct procent (16 %) inklisiranu je vyloučeno ledvinami.
-
Linearita/nelinearita
V klinické studii fáze I bylo po podání subkutánních dávek pozorováno přibližně dávce úměrné zvýšení expozice inklisiranu v rozmezí od 24 mg do 756 mg. Po opakovaných subkutánních dávkách inklisiranu nebyla pozorována akumulace ani na čase závislé změny.
-
Farmakokinetické/farmakodynamické vztahy
V klinické studii fáze I byla pozorována disociace mezi farmakokinetickými parametry inklisiranu a farmakodynamickými účinky na LDL-C. Selektivní dodání inklisiranu do hepatocytů, kde je inkorporován do tlumícího komplexu indukovaného RNA (RISC), má za následek dlouhé trvání účinku nad rámec předpokládaného účinku na základě plazmatického poločasu eliminace 9 hodin. Maximální účinky snížení LDL-C byly pozorovány při dávce 284 mg, přičemž vyšší dávky nevyvolávaly větší účinek.
-
Zvláštní populace
Porucha funkce ledvin
Farmakokinetická analýza údajů ze specializované studie poruchy funkce ledvin zaznamenala zvýšení Cmax inklisiranu přibližně 2,3, 2,0 a 3,3krát a zvýšení AUC inklisiranu přibližně 1,6, 1,8 a 2,3krát u pacientů s lehkou (kreatininová clearance [CLCr] 60 ml/min až 89 ml/min), středně těžkou (CLCr 30 ml/min až 59 ml/min) a těžkou (CLCr 15 ml/min až 29 ml/min) poruchou funkce ledvin, v porovnání s pacienty s normální funkcí ledvin. Přes vyšší přechodné plazmatické expozice v průběhu 48 hodin bylo snížení LDL-C podobné ve všech skupinách renálních funkcí. Na základě populačního farmakodynamického modelování se u pacientů s konečným onemocněním ledvin nedoporučuje úprava dávky. Na základě farmakokinetických, farmakodynamických a bezpečnostních hodnocení není nutná úprava dávky u pacientů s lehkou, středně těžkou nebo těžkou poruchou funkce ledvin. Účinek hemodialýzy na farmakokinetiku inklisiranu nebyl studován. Vzhledem k tomu, že inklisiran je vylučován ledvinami, neměla by se hemodialýza provádět po dobu nejméně 72 hodin po podání přípravku Leqvio.Porucha funkce jater
Farmakokinetická analýza údajů ze specializované studie poruchy funkce jater hlásila zvýšení Cmax inklisiranu přibližně 1,1 a 2,1krát a zvýšení AUC incisiranu přibližně 1,3 a 2,0krát u pacientů s lehkou (ChildPugh třída A) a středně těžkou (ChildPugh třída B) poruchou funkce jater ve srovnání s pacienty s normální funkcí jater. Navzdory vyšším přechodným plazmatickým expozicím inklisiranu bylo snížení LDL-C pdobné u skupin pacientů s normální funkcí jater a lehkou poruchou funkce jater, kterým byl podáván inklisiran. U pacientů se středně těžkou poruchou funkce jater byly základní hladiny PCSK9 výrazně nižší a snížení LDL-C bylo nižší než u pacientů s normální funkcí jater. U pacientů s lehkou až středně těžkou poruchou funkce jater (Child-Pugh třída A a B) není nutná úprava dávky. Přípravek Leqvio nebyl studován u pacientů s těžkou poruchou funkce jater (Child-Pugh třída C).Jiné zvláštní populace
Populační farmakodynamická analýza byla provedena na datech od 4328 pacientů. Nebylo zjištěno, že by věk, tělesná hmotnost, pohlaví, rasa a clearance kreatininu významně ovlivnily farmakodynamiku inklisiranu. U pacientů s touto demografií se nedoporučuje úprava dávky.
-
-
5.3 Předklinické údaje vztahující se k bezpečnosti
V toxikologických studiích po opakovaných dávkách prováděných na potkanech a opicích byla dávka, při které není pozorován žádný nepříznivý účinek na organismus (NOAEL) zjištěna při nejvyšších dávkách podávaných subkutánně, která vyvolala expozice značně převyšující maximální expozici u člověka. Mikroskopická pozorování z toxikologických studií zahrnovala vakuolizaci v hepatocytech potkanů a makrofágů lymfatických uzlin opic a přítomnost bazofilních granulí v hepatocytech opic a ledvinách potkanů a opic. Tato pozorování nebyla spojena se změnami v klinických laboratorních parametrech a nejsou považována za nežádoucí.
Inklisiran nebyl karcinogenní u potkanů Sprague-Dawley nebo u myší TgRasH2, kterým byl podáván inklisiran v dávkách významně převyšujících klinické dávky.
V řadě testů, včetně testu bakteriální mutagenity, testu chromozomální aberace v lymfocytech lidské periferní krve
in vitro a mikronukleárního testu kostní dřeně krysy in vivo, nebyl nalezen žádný mutagenní nebo klastogenní potenciál inklisiranu.Reprodukční studie provedené na potkanech a králících neodhalily žádné známky poškození plodu v inklisiranem při nejvyšších podaných dávkách, které znamenaly expozici značně převyšující maximální expozici člověka.
Inklisiran neovlivnil plodnost ani reprodukční výkonnost samců a samic potkanů vystavených inklisiranu před zabřeznutím a během březosti. Dávky byly spojeny se systémovými expozicemi mnohonásobně vyššími než je expozice u člověka po klinických dávkách.
Inklisiran byl pozorován v mléku kojících potkanů; neexistuje však důkaz o systémové absorpci u kojených mláďat potkanů.
6. FARMACEUTICKÉ ÚDAJE
-
6.1 Seznam pomocných látek
Voda pro injekci
Hydroxid sodný (k úpravě pH)
Koncentrovaná kyselina fosforečná (k úpravě pH)
-
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
-
6.3 Doba použitelnosti
3 roky
-
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání. Chraňte před mrazem.
-
6.5 Druh obalu a obsah balení
-
Předplněná injekční stříkačka
1,5 ml roztoku v předplněné injekční stříkačce (sklo třídy I) s pístovou zátkou (brombutyl, fluorotekem potažená pryž) s jehlou a pevným krytem jehly.
Velikost balení jedna předplněná injekční stříkačka.
-
Předplněná injekční stříkačka s ochranným pouzdrem jehly
1,5 ml roztoku v předplněné injekční stříkačce (sklo třídy I) s pístovou zátkou (brombutyl, fluorotekem potažená pryž) s jehlou, pevným krytem jehly a s ochranným pouzdrem jehly.
Velikost balení jedna předplněná injekční stříkačka s ochranným pouzdrem jehly.
Na trhu nemusí být všechny velikosti balení.
-
-
6.6 Zvláštní opatření pro likvidaci přípravku
Přípravek Leqvio musí být před podáním vizuálně zkontrolován. Roztok má být čirý, bezbarvý až světle žlutý a prakticky prostý částic. Pokud roztok obsahuje viditelné částice, nesmí být použit.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irsko
8. REGISTRAČNÍ ČÍSLO/REGISTRAČNÍ ČÍSLA
EU/1/20/1494/001
EU/1/20/1494/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. prosince 2020
10. DATUM REVIZE TEXTU
24. března 2022
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu [3]
Zkrácená informace o přípravku v pdf → [4]
# SÚKL, sukl.gov.cz [5]