Přípravek LEQVIO® byl dobře tolerován ve třech pivotních studiích fáze III po dobu 18 měsíců1

Ve třech pivotních klinických hodnoceních fáze III během období 18 měsíců1
- V dosavadních klinických hodnoceních bylo sledováno > 5 000 pacientů s více než 5 700 pacientoroky expozice přípravku LEQVIO.2–6
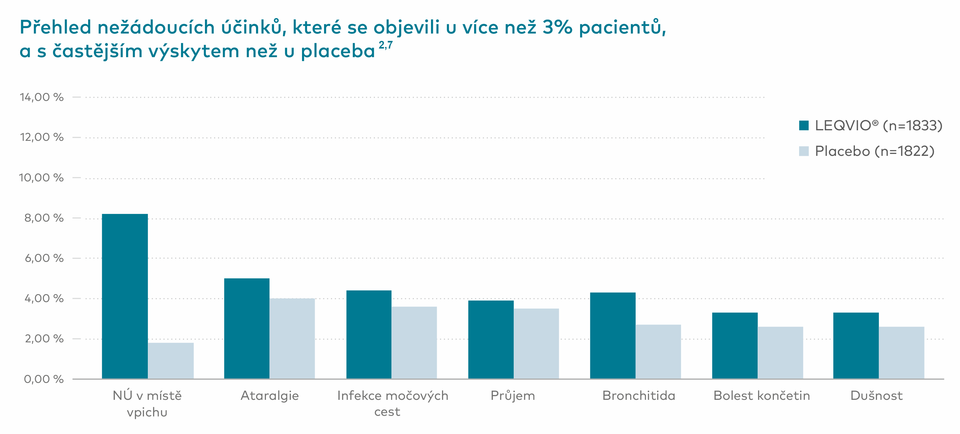
- Nejčastějšími nežádoucími účinky byly reakce v místě vpichu, které byly převážně mírné a žádná nevedla k přerušení léčby (8,2 % vs. 1,8 % u placeba).1
- U přípravku LEQVIO nejsou očekávány klinicky významné mezilékové interakce.1
Další stránka: Seznamte se s mechanismem účinku →
Přerušení léčby z důvodu nežádoucích účinků bylo podobné u pacientů užívajících přípravek LEQVIO (2,5 %) vs. placebo (1,9 %).2,3*
Nejčastějšími nežádoucími účinky hlášenými v jednom nebo několika klinických hodnoceních (u ≥ 3 % pacientů léčených přípravkem LEQVIO a vyskytujícími se častěji než u placeba) byly reakce v místě vpichu, artralgie, infekce močových cest, průjem, bronchitida, bolest končetin a dušnost.2,3*
Údaje o bezpečnosti pocházejí ze tří placebem kontrolovaných klinických hodnocení (ORION-9, ORION-10, ORION-11).1
