▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Pluvicto 1 000 MBq/ml injekční/infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje 1 000 MBq lutecia‑(177Lu) vipivotidu tetraxetanu ke dni a času kalibrace.
Celkové množství radioaktivity na jednodávkovou injekční lahvičku je 7 400 MBq ± 10 % ke dni a času podání. Vzhledem k fixní objemové aktivitě 1 000 MBq/ml ke dni a času kalibrace se objem roztoku v injekční lahvičce může pohybovat od 7,5 ml do 12,5 ml, aby bylo zajištěno požadované množství radioaktivity ke dni a času podání.
Fyzikální vlastnosti
Lutetium-177 se rozkládá emisí beta mínus záření o maximální energii 0,498 MeV (79 %) a vyzářením fotonů (γ) o energii 0,208 MeV (11 %) a 0,113 MeV (6,4 %) na stabilní hafnium-177 s poločasem přeměny 6,647 dnů.
Pomocná látka se známým účinkem
Jeden ml roztoku obsahuje až 0,312 mmol (7,1 mg) sodíku. Jedna injekční lahvička obsahuje až 88,75 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční/infuzní roztok.
Čirý, bezbarvý až nažloutlý roztok, pH: 4,5 až 7,0.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Pluvicto v kombinaci s androgen deprivační terapií (ADT) s nebo bez inhibice dráhy androgenního receptoru (AR) je indikován k léčbě dospělých pacientů s progresivním metastazujícím kastračně rezistentním karcinomem prostaty (mCRPC) pozitivním na prostatický specifický membránový antigen (PSMA), kteří byli léčeni inhibicí dráhy AR a chemoterapií na bázi taxanů (viz bod 5.1).
4.2 Dávkování a způsob podání
Důležité bezpečnostní pokyny
Přípravek Pluvicto mohou podávat pouze osoby oprávněné k zacházení s radiofarmaky v určených klinických podmínkách (viz bod 6.6), a to po zhodnocení pacienta kvalifikovaným lékařem.
Radiofarmaka, včetně přípravku Pluvicto, mají být používána zdravotnickými pracovníky nebo pod dohledem těchto pracovníků, kteří jsou kvalifikovaní specifickým školením a mají zkušenosti s bezpečným používáním radiofarmak a manipulací s nimi a jejichž zkušenosti a školení byly schváleny příslušnou vládní agenturou oprávněnou udělovat licenci k použití radiofarmak.
Identifikace pacienta
Pacienti mají být identifikováni pro léčbu pomocí zobrazení PSMA.
Dávkování
Doporučený léčebný režim přípravku Pluvicto je 7 400 MBq intravenózně každých 6 týdnů (± 1 týden) až do celkového počtu 6 dávek, pokud nedojde k progresi onemocnění nebo nepřijatelné toxicitě.
U pacientů, kteří nejsou chirurgicky kastrováni, má během léčby pokračovat chemická kastrace analogem hormonu uvolňujícího gonadotropin (GnRH).
Monitorování léčby
Před a během léčby přípravkem Pluvicto mají být provedeny laboratorní testy. Dávkování může být nutné upravit na základě výsledků testu (viz tabulka 1).
- Hematologie (hemoglobin, počet leukocytů, absolutní počet neutrofilů, počet trombocytů)
- Funkce ledvin (sérový kreatinin, vypočtená clearance kreatininu [Clcr])
- Funkce jater (alaninaminotransferáza, aspartátaminotransferáza, alkalická fosfatáza, albumin v krevním séru, celkový bilirubin v krvi)
Úprava dávky z důvodu nežádoucích účinků
Doporučené úpravy dávky přípravku Pluvicto z důvodu nežádoucích účinků jsou uvedeny v tabulce 1. Zvládnutí závažných a netolerovatelných nežádoucích účinků může vyžadovat dočasné přerušení dávkování (prodloužení dávkovacího intervalu o 4 týdny z 6 až na 10 týdnů), snížení dávky nebo trvalé ukončení léčby přípravkem Pluvicto. Pokud zpoždění léčby v důsledku nežádoucího účinku přetrvává déle než 4 týdny, musí být léčba přípravkem Pluvicto ukončena. Dávku přípravku Pluvicto lze jednorázově snížit o 20 %; dávka se nemá znovu zvyšovat. Pokud má pacient další nežádoucí účinky, které by vyžadovaly další snížení dávky, musí být léčba přípravkem Pluvicto ukončena.
Tabulka 1 Doporučené úpravy dávky přípravku Pluvicto z důvodu nežádoucích účinků
| Nežádoucí účinek | Závažnosta | Úprava dávky |
| Sucho v ústech | Stupeň 3 | Snižte dávku přípravku Pluvicto o 20 %. |
| Gastrointestinální toxicita | Stupeň ≥ 3 (nepodléhající lékařskému zásahu) | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 2 nebo výchozí hodnotu. Snižte dávku přípravku Pluvicto o 20 %. |
| Anemie, trombocytopenie, leukopenie, neutropenie, pancytopenie | Stupeň 2 | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 1 nebo výchozí hodnotu. Postupujte, jak uznáte za vhodné. Použití růstových faktorů je povoleno, ale má být přerušeno, jakmile dojde ke zlepšení na stupeň 1 nebo výchozí hodnotu. Doporučuje se kontrola hematologických hladin (železo, B12 a folát) a poskytování suplementace. Transfuze mohou být podávány podle klinické indikace. |
| Stupeň ≥ 3 | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 1 nebo výchozí hodnotu. Snižte dávku přípravku Pluvicto o 20 %. |
|
| Renální toxicita | Definována jako:
|
Přerušte podávání přípravku Pluvicto až do zlepšení. |
Definovaná jako:
a
|
Přerušte podávání přípravku Pluvicto až do zlepšení nebo návratu k výchozí hodnotě. Snižte dávku přípravku Pluvicto o 20 %. |
|
| Rekurentní renální toxicita (stupeň ≥ 3) | Trvale ukončete léčbu přípravkem Pluvicto. | |
| Komprese míchy | Jakákoli | Přeruště podávání přípravku Pluvicto, dokud nebude komprese adekvátně ošetřena a jakékoli neurologické následky se nestabilizují, stejně jako výkonnostní stav ECOG. |
| Zlomenina nosných kostí | Jakákoli | Přeruště podávání přípravku Pluvicto, dokud nebude zlomenina adekvátně stabilizována/ošetřena a výkonnostní stav ECOG se stabilizuje. |
| Únava | Stupeň ≥ 3 | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 2 nebo výchozí hodnotu. |
| Elektrolytové nebo metabolické abnormality | Stupeň ≥ 2 | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 1 nebo výchozí hodnotu. |
| Nehematologická toxicita (klinicky významná, jinak není uvedeno) | Stupeň ≥ 2 | Přerušte podávání přípravku Pluvicto až do zlepšení na stupeň 1 nebo výchozí hodnotu. |
| Elevace AST nebo ALT | AST nebo ALT > 5násobek ULN při absenci jaterních metastáz | Trvale ukončete léčbu přípravkem Pluvicto. |
| Zkratky: Clcr, clearance kreatininu; ECOG, Eastern Cooperative Oncology Group; AST, aspartátaminotransferáza; ALT, alaninaminotransferáza; ULN, horní hranice normálu (upper limit of normal). Hodnocení podle Obecných terminologických kritérií pro nežádoucí účinky (Common Terminology Criteria for Adverse Events – CTCAE). a Stejné prahové hodnoty platí také pro výchozí hodnoty v době zahájení léčby přípravkem Pluvicto. |
||
Zvláštní populace
Starší pacienti
U pacientů ve věku 65 let nebo starších se nedoporučuje žádná úprava dávky.
Porucha funkce ledvin
U pacientů s lehkou až středně těžkou poruchou funkce ledvin s výchozí hodnotou Clcr ≥ 50 ml/min podle Cockcrofta a Gaulta se nedoporučuje žádná úprava dávky. Léčba přípravkem Pluvicto se nedoporučuje u pacientů se středně těžkou až těžkou poruchou funkce ledvin s výchozí hodnotou Clcr < 50 ml/min nebo s terminálním onemocněním ledvin, protože farmakokinetický profil a bezpečnost přípravku Pluvicto nebyly u těchto pacientů studovány (viz body 4.4 a 5.2).
Porucha funkce jater
U pacientů s poruchou funkce jater se nedoporučuje žádná úprava dávky. Přípravek Pluvicto nebyl hodnocen u pacientů se středně těžkou nebo těžkou poruchou funkce jater (viz bod 5.2).
Pediatrická populace
Použití přípravku Pluvicto v indikaci léčby karcinomu prostaty exprimujícího PSMA u pediatrické populace není relevantní.
Způsob podání
Přípravek Pluvicto je injekční/infuzní roztok připravený k použití pouze k jednorázovému podání.
Pokyny pro podání
Doporučená dávka přípravku Pluvicto může být podána intravenózně formou injekce pomocí jednorázové injekční stříkačky opatřené stíněním (s injekční pumpou, nebo bez ní), formou infuze s použitím gravitační metody (s infuzní pumpou, nebo bez ní), formou infuze pomocí injekční lahvičky (s peristaltickou infuzní pumpou).
Snížená dávka přípravku Pluvicto má být podána za použití injekční metody (s injekční pumpou, nebo bez ní) nebo za použití metody s injekční lahvičkou (s peristaltickou infuzní pumpou). Použití gravitační metody k podání snížené dávky přípravku Pluvicto se nedoporučuje, protože může vést k podání nesprávného objemu přípravku Pluvicto, pokud se dávka před podáním neupraví.
Před podáním propláchněte intravenózní katetr používaný výhradně k aplikaci přípravku Pluvicto ≥ 10 ml sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%), abyste zajistili průchodnost a minimalizovali riziko extravazace. Případy extravazace mají být řešeny podle směrnic dané instituce. Pacienti mají být poučeni, aby zůstali dobře hydratovaní a často močili před a po podání přípravku Pluvicto (viz bod 4.4).
Návod ke způsobu přípravy a intravenóznímu podání je uveden v bodě 12.
Pokyny k přípravě pacienta viz bod 4.4.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Individuální odůvodnění přínosů/rizik
U každého pacienta musí být radiační expozice odůvodněna pravděpodobným přínosem. Podaná dávka radioaktivity má být v každém případě tak nízká, jak je rozumně dosažitelné, aby bylo možné zajistit požadovaný terapeutický efekt.
Riziko vystavení radiaci
Přípravek Pluvicto přispívá k celkové dlouhodobé kumulativní radiační expozici pacienta. Dlouhodobá kumulativní radiační expozice je spojena se zvýšeným rizikem vzniku nádorových onemocnění.
Radiační expozice pacientů, zdravotnického personálu a kontaktů v domácnosti má být během léčby přípravkem Pluvicto a po ní minimalizována v souladu se správnou praxí radiační bezpečnosti dané instituce, s postupy péče o pacienty a pokyny pro pacienta ohledně následné radiační ochrany doma.
Příprava pacienta
Pacienti mají být vyzváni, aby zvýšili množství perorálních tekutin a zároveň co nejčastěji močili, aby se snížila radiace močového měchýře, zvláště po vysokých aktivitách, např. při radionuklidové terapii.
Po výkonu
Před propuštěním pacienta má radiolog nebo zdravotnický pracovník vysvětlit nezbytná radioprotektivní opatření, která má pacient dodržovat, aby se minimalizovala radiační zátěž ostatních.
Po každém podání přípravku Pluvicto lze zvážit následující obecná doporučení pro pacienty spolu s národními, místními a institucionálními postupy a předpisy.
- Omezit blízký kontakt (méně než 1 metr) s ostatními členy domácnosti po dobu 2 dnů nebo s dětmi a těhotnými ženami po dobu 7 dnů.
- Zdržet se sexuální aktivity po dobu 7 dnů.
- Spát v ložnici oddělené od ostatních členů domácnosti po dobu 3 dnů, od dětí po dobu 7 dnů nebo od těhotných žen po dobu 15 dnů.
Myelosuprese
Ve studii VISION se myelosuprese, včetně fatálních případů, vyskytovala častěji u pacientů, kteří dostávali přípravek Pluvicto s nejlepší standardní péčí (Best Standard of Care, BSoC), ve srovnání s pacienty, kteří dostávali samotnou BSoC (viz bod 4.8).
Před a během léčby přípravkem Pluvicto mají být provedeny hematologické laboratorní testy, které zahrnují hemoglobin, počet leukocytů, absolutní počet neutrofilů a počet trombocytů. Přípravek Pluvicto má být vysazen, dávka snížena nebo léčba trvale ukončena a pacienti mají být klinicky léčeni dle vhodnosti na základě závažnosti myelosuprese (viz bod 4.2).
Renální toxicita
Ve studii VISION se renální toxicita vyskytovala častěji u pacientů, kteří dostávali přípravek Pluvicto s BSoC, ve srovnání s pacienty, kteří dostávali samotnou BSoC (viz bod 4.8).
Před a po podání přípravku Pluvicto mají být pacienti vyzváni, aby zvýšili množství perorálních tekutin a zároveň co nejčastěji močili, zejména po vysokých dávkách, např. při radionuklidové terapii. Laboratorní testy funkce ledvin, včetně sérového kreatininu a vypočtené Clcr, mají být provedeny před a během léčby přípravkem Pluvicto. Přípravek Pluvicto má být vysazen, dávka snížena nebo léčba trvale ukončena na základě závažnosti renální toxicity (viz bod 4.2).
Porucha funkce ledvin/jater
U těchto pacientů je nutné pečlivě zvážit poměr přínosů a rizik, protože je možná zvýšená radiační zátěž.
Očekává se, že expozice (AUC) luteciu-(177Lu) vipivotidu tetraxetanu se bude zvyšovat se stupněm poruchy funkce ledvin (viz bod 5.2). U pacientů s lehkou nebo středně těžkou poruchou funkce ledvin může být vyšší riziko toxicity. U pacientů s lehkou až středně těžkou poruchou funkce ledvin je třeba sledovat renální funkce a nežádoucí účinky (viz bod 4.2). Léčba přípravkem Pluvicto se nedoporučuje u pacientů se středně těžkou až těžkou poruchou funkce ledvin s výchozí hodnotou Clcr < 50 ml/min nebo s onemocněním ledvin v terminálním stádiu.
Fertilita
Radiace lutecia‑(177Lu) vipivotidu tetraxetanu může mít potenciálně toxické účinky na mužské pohlavní žlázy a spermatogenezi. Doporučená kumulativní dávka 44 400 MBq přípravku Pluvicto má za následek radiaci absorbovanou do varlat v rozsahu, kdy přípravek Pluvicto může způsobit neplodnost. Pokud si pacient přeje mít po léčbě děti, doporučuje se genetická konzultace. Před léčbou lze s pacienty mužského pohlaví diskutovat o možnosti kryokonzervace spermatu (viz bod 4.6).
Antikoncepce u mužů
Pacientům (mužům) se doporučuje, aby během léčby přípravkem Pluvicto a po dobu 14 týdnů po poslední dávce nepočali dítě a při pohlavním styku používali kondom (viz bod 4.6).
Zvláštní upozornění
Obsah sodíku
Tento léčivý přípravek obsahuje až 3,9 mmol (88,75 mg) sodíku v jedné injekční lahvičce, což odpovídá 4,4 % doporučeného maximálního denního příjmu sodíku potravou podle WHO pro dospělého, který činí 2 g sodíku.
Opatření s ohledem na nebezpečí pro životní prostředí viz bod 6.6.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné klinické studie lékových interakcí.
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů
Vzhledem k potenciálním účinkům na spermatogenezi související s radiací lutecia‑(177Lu) vipivotidu tetraxetanu se pacientům mužského pohlaví doporučuje, aby během léčby přípravkem Pluvicto a po dobu 14 týdnů po poslední dávce nepočali dítě a při pohlavním styku používali kondom (viz bod 4.4).
Těhotenství
Přípravek Pluvicto není indikován k použití u žen. Nebyly provedeny žádné studie na zvířatech s použitím lutecia‑(177Lu) vipivotidu tetraxetanu k hodnocení jeho účinku na samičí reprodukci a embryofetální vývoj. Nicméně všechna radiofarmaka, včetně přípravku Pluvicto, mají potenciál způsobit poškození plodu při podání těhotné ženě.
Kojení
Přípravek Pluvicto není indikován k použití u žen. Neexistují žádné údaje o přítomnosti lutecia‑(177Lu) vipivotidu tetraxetanu v mateřském mléce nebo jeho účincích na kojeného novorozence/kojence nebo na produkci mléka.
Fertilita
Nebyly provedeny žádné studie ke stanovení účinků lutecia‑(177Lu) vipivotidu tetraxetanu na fertilitu. Radiace lutecia‑(177Lu) vipivotidu tetraxetanu může mít potenciálně toxické účinky na mužské pohlavní žlázy a spermatogenezi. Doporučená kumulativní dávka 44 400 MBq přípravku Pluvicto má za následek radiaci absorbovanou do varlat v rozsahu, kdy přípravek Pluvicto může způsobit neplodnost. Pokud si pacient přeje mít po léčbě děti, doporučuje se genetická konzultace. Před léčbou lze s pacienty mužského pohlaví diskutovat o možnosti kryokonzervace spermatu (viz bod 4.4).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Pluvicto může mít malý vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Pokud není uvedeno jinak, frekvence uvedených nežádoucích účinků je založena na údajích ze studie VISION, ve které 529 pacientů dostalo alespoň jednu dávku 7 400 MBq (medián počtu dávek byl pět).
Mezi nejčastější nežádoucí účinky patří: únava (43,1 %), sucho v ústech (39,3 %), nauzea (35,3 %), anemie (31,8 %), snížená chuť k jídlu (21,2 %) a zácpa (20,2 %). Mezi nejčastější nežádoucí účinky stupně 3 až 4 patří: anemie (12,9 %), trombocytopenie (7,9 %), lymfopenie (7,8 %) a únava (5,9 %).
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky (tabulka 2) jsou uvedeny podle tříd orgánových systémů databáze MedDRA. V každé třídě orgánových systémů jsou nežádoucí účinky seřazeny podle frekvence, přičemž nejčastější nežádoucí účinky jsou na prvním místě. Odpovídající kategorie četnosti pro každý nežádoucí účinek je navíc založena na následující konvenci (CIOMS III): velmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); méně časté (≥ 1/1 000 až < 1/100); vzácné (≥ 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000).
Tabulka 2 Nežádoucí účinky vyskytující se s vyšší incidencí u pacientů, kteří dostávali přípravek Pluvicto plus BSoC ve srovnání se samotnou BSoC ve studii VISIONa
| Třídy orgánových systémů Nežádoucí účinek |
Kategorie frekvence | Všechny stupně n (%) |
Stupně 3 až 4b n (%) |
| Poruchy krve a lymfatického systému | |||
| Anemie | Velmi časté | 168 (31,8) | 68 (12,9) |
| Trombocytopenie | Velmi časté | 91 (17,2) | 42 (7,9) |
| Leukopeniec | Velmi časté | 83 (15,7) | 22 (4,2) |
| Lymfopenie | Velmi časté | 75 (14,2) | 41 (7,8) |
| Pancytopenied | Časté | 9 (1,7) | 7 (1,3)b |
| Poruchy nervového systému | |||
| Závrať | Časté | 44 (8,3) | 5 (0,9) |
| Bolest hlavy | Časté | 37 (7,0) | 4 (0,8) |
| Dysgeuziee | Časté | 37 (7,0) | 0 (0,0) |
| Poruchy oka | |||
| Suché oko | Časté | 16 (3,0) | 0 (0,0) |
| Poruchy ucha a labyrintu | |||
| Vertigo | Časté | 11 (2,1) | 0 (0,0) |
| Gastrointestinální poruchy | |||
| Sucho v ústechf | Velmi časté | 208 (39,3) | 0 (0,0) |
| Nauzea | Velmi časté | 187 (35,3) | 7 (1,3) |
| Zácpa | Velmi časté | 107 (20,2) | 6 (1,1) |
| Zvraceníg | Velmi časté | 101 (19,1) | 5 (0,9) |
| Průjem | Velmi časté | 100 (18,9) | 4 (0,8) |
| Bolest břichah | Velmi časté | 59 (11,2) | 6 (1,1) |
| Poruchy ledvin a močových cest | |||
| Infekce močových cesti | Velmi časté | 61 (11,5) | 20 (3,8) |
| Akutní poškození ledvinj | Časté | 45 (8,5) | 17 (3,2) |
| Celkové poruchy a reakce v místě aplikace | |||
| Únava | Velmi časté | 228 (43,1) | 31 (5,9) |
| Snížená chuť k jídlu | Velmi časté | 112 (21,2) | 10 (1,9) |
| Pokles tělesné hmotnosti | Velmi časté | 57 (10,8) | 2 (0,4) |
| Periferní edémk | Časté | 52 (9,8) | 2 (0,4) |
| Pyrexie | Časté | 36 (6,8) | 2 (0,4) |
| Zkratky: BSoC, nejlepší standardní péče. a Obecná terminologická kritéria pro nežádoucí účinky podle National Cancer Institute Common Terminology Criteria for Adverse Events - NCI CTCAE Verze 5.0. b Zahrnuje pouze nežádoucí účinky stupně 3 až 4, s výjimkou pancytopenie. Pancytopenie stupně 5 (fatální) byla hlášena u 2 pacientů, kteří dostali přípravek Pluvicto plus BSoC. c Leukopenie zahrnuje leukopenii a neutropenii. d Pancytopenie zahrnuje pancytopenii a bicytopenii. e Dysgeuzie zahrnuje dysgeuzii a poruchu chuti. f Sucho v ústech zahrnuje sucho v ústech, aptyalismus a sucho v krku. g Zvracení zahrnuje zvracení a dávení. h Bolest břicha zahrnuje bolest břicha, bolest v horní části břicha, abdominální diskomfort, bolest v dolní části břicha, citlivost břicha a bolest gastrointestinálního traktu. i Infekce močových cest zahrnuje infekci močových cest, cystitidu a bakteriální cystitidu. j Akutní poškození ledvin zahrnuje zvýšení kreatininu v krvi, akutní poškození ledvin, selhání ledvin a zvýšenou hladinu močoviny v krvi. k Periferní edém zahrnuje periferní edém, retenci tekutin a přetížení tekutinami. |
|||
Popis vybraných nežádoucích účinků
Myelosuprese
Ve studii VISION se myelosuprese vyskytovala častěji u pacientů, kteří dostávali přípravek Pluvicto plus nejlepší standardní péči (BSoC), ve srovnání s pacienty, kteří dostávali samotnou BSoC (všechny stupně/stupeň ≥ 3): anemie (31,8 %/12,9 %) versus (13,2 %/4,9 %); trombocytopenie (17,2 %/7,9 %) versus (4,4 %/1,0 %); leukopenie (12,5 %/2,5 %) versus (2,0 %/0,5 %); lymfopenie (14,2 %/7,8 %) versus (3,9 %/0,5 %); neutropenie (8,5 %/3,4 %) versus (1,5 %/0,5 %); pancytopenie (1,5 %/1,1 %) versus (0 %/0 %) včetně dvou fatálních příhod pancytopenie u pacientů, kteří dostávali přípravek Pluvicto plus BSoC; a bicytopenie (0,2 %/0,2 %) versus (0 %/0 %).
Myelosupresivní nežádoucí účinky, které vedly k trvalému ukočení léčby u ≥ 0,5 % pacientů, kteří dostávali přípravek Pluvicto plus BSoC zahrnovaly: anemii (2,8 %), trombocytopenii (2,8 %), leukopenii (1,3 %), neutropenii (0,8 %) a pancytopenii (0,6 %). Myelosupresivní nežádoucí účinky, které vedly k přerušení léčby / snížení dávky u ≥ 0,5 % pacientů, kteří dostávali přípravek Pluvicto plus BSoC zahrnovaly: anemii (5,1 %/1,3 %), trombocytopenii (3,6 %/1,9 %), leukopenii (1,5 %/0,6 %) a neutropenii (0,8 %/0,6 %).
Renální toxicita
Ve studii VISION se renální toxicita vyskytovala častěji u pacientů, kteří dostávali přípravek Pluvicto plus BSoC ve srovnání s pacienty, kteří dostávali samotnou BSoC (všechny stupně/stupeň 3 až 4): zvýšení kreatininu v krvi (5,3 %/0,2 %) versus (2,4 %/0,5 %); akutní poškození ledvin (3,6 %/3,0 %) versus (3,9 %/2,4 %); selhání ledvin (0,2 %/0 %) versus (0 %/0 %); a zvýšení močoviny v krvi (0,2 %/0 %) versus (0 %/0 %).
Renální nežádoucí účinky, které vedly k trvalému ukončení léčby u ≥ 0,2 % pacientů, kteří dostávali přípravek Pluvicto plus BSoC, zahrnovaly: zvýšení kreatininu v krvi (0,2 %). Renální nežádoucí účinky, které vedly k přerušení léčby / snížení dávky u ≥ 0,2 % pacientů, kteří dostávali přípravek Pluvicto plus BSoC, zahrnovaly: zvýšení kreatininu v krvi (0,2 %/0,4 %) a akutní poškození ledvin (0,2 %/0 %).
Druhé primární malignity
Expozice ionizujícímu záření je spojena s indukcí nádorových onemocnění a potenciálem rozvoje dědičných vad. Radiační dávka vyplývající z terapeutické expozice může mít za následek vyšší výskyt nádorových onemocnění a mutací. Ve všech případech je nutné zajistit, aby riziko radiace bylo menší než z onemocnění samotného. Jelikož přípravek Pluvicto přispívá k celkové dlouhodobé radiační expozici pacienta, která je spojena se zvýšeným rizikem vzniku nádorového onemocnění (viz bod 4.4), nelze u radiofarmak, jako je přípravek Pluvicto, vyloučit potenciální riziko druhých primárních malignit. V době primární analýzy studie VISION (datum uzávěrky 27. ledna 2021) byly u pacientů, kteří dostávali přípravek Pluvicto plus BSoC, hlášeny případy spinocelulárního karcinomu (4 pacienti; 0,8 %) a bazocelulárního karcinomu, maligního melanomu a spinocelulárního karcinomu kůže (u každého případu 1 pacient; 0,2 % v každém z případů).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41
Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
V případě podání nadměrné radiační dávky přípravku Pluvicto je třeba snížit dávku absorbovanou pacientem, jak je to jen možné, a to zvýšením eliminace radionuklidu z organismu častou mikcí nebo nucenou diurézou a častým vyprazdňováním močového měchýře. Může být užitečné, odhadnout efektivní dávku, která byla aplikována.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Terapeutická radiofarmaka, Jiná terapeutická radiofarmaka, ATC kód: V10XX05
Mechanismus účinku
Aktivní složkou přípravku Pluvicto je radionuklid lutecium-177, který je spojen s malou molekulou ligandu, který cílí a váže se s vysokou afinitou na PSMA, transmembránový protein, který je vysoce exprimován u karcinomu prostaty, včetně mCRPC. Po navázání přípravku Pluvicto na nádorové buňky exprimující PSMA, emise beta mínus z lutecia‑177 dodává terapeutické záření do cílové buňky, stejně jako do okolních buněk, a indukuje poškození DNA, které může vést k buněčné smrti.
Farmakodynamické účinky
Neznačený vipivotid tetraxetan nemá žádnou farmakodynamickou aktivitu.
Klinická účinnost a bezpečnost
VISION
Účinnost přípravku Pluvicto u pacientů s progresivním, PSMA pozitivním mCRPC byla hodnocena ve fázi III randomizované, multicentrické, otevřené studii VISION. Osm set třicet jedna (n=831) dospělých pacientů bylo randomizováno (2:1), aby dostávali buď přípravek Pluvicto 7 400 MBq každých 6 týdnů až do celkového počtu 6 dávek plus nejlepší standardní péči (BSoC) (n=551) nebo samotnou BSoC (n=280). U pacientů, kteří dostali 4 dávky přípravku Pluvicto, byla znovu posouzena odpověď na léčbu, známky reziduálního onemocnění a snášenlivost a dle uvážení lékaře mohli tito pacienti dostat až 2 další dávky.
Pro udržení kastračního stavu všichni pacienti nadále dostávali analoga GnRH nebo podstoupili předchozí bilaterální orchiektomii. Vhodní pacienti museli mít progresivní, PSMA pozitivní mCRPC, výkonnostní stav (PS, performace status) podle Eastern Cooperative Oncology Group (ECOG) hodnoty 0 až 2, alespoň jednu metastatickou lézi detekovanou na počítačové tomografii (CT), magnetické rezonanci (MRI) nebo kostním skenu a adekvátní renální, hepatální a hematologické funkce.
Od vhodných pacientů se také vyžadovalo, aby dostávali alespoň jeden inhibitor dráhy AR, jako je abirateron-acetát nebo enzalutamid, a 1 nebo 2 předchozí chemoterapeutické režimy založené na taxanu (s režimem definovaným jako minimální expozice 2 cyklům taxanu). Pacienti léčeni pouze 1 předchozím chemoterapeutickým režimem na bázi taxanu byli vhodní, pokud pacient nebyl ochoten podstoupit druhý režim nebo lékař nepovažoval pacienta za vhodného pro příjem druhého režimu. Pacienti s nestabilními symptomatickými metastázami centrálního nervového systému nebo symptomatickou nebo klinicky/radiologicky hrozící kompresí míchy nebyli způsobilí pro studii. Pacienti podstoupili pozitronovou emisní tomografii (PET) s použitím gallium-(68Ga)-gozetotidu k vyhodnocení exprese PSMA v lézích definovaných centrálními čtecími kritérii. Od vhodných pacientů se vyžadovalo, aby měli PSMA pozitivní mCRPC definovaný výskytem alespoň jedné nádorové léze s vychytáváním gallium-(68Ga)-gozetotidu větším než v normálních játrech. Pacienti byli vyloučeni, pokud jakékoli léze překračující velikostní kritéria v krátké ose (orgány ≥ 1 cm, lymfatické uzliny ≥ 2,5 cm, kosti [měkké složky tkáně] ≥ 1 cm) měly vychytávání menší nebo shodné s vychytáváním v normálních játrech.
BSoC podávaná podle uvážení lékaře zahrnovala: podpůrná opatření včetně zvládání bolesti, hydratace, krevní transfuze, atd.; ketokonazol; radiační terapii (včetně formy použití radioaktivních zrn nebo jakékoli externí radioterapie [včetně stereotaktické radioterapie těla a paliativní externí radioterapie]) lokalizovaných cílů karcinomu prostaty; látky cílené na kosti včetně kyseliny zoledronové, denosumabu a jakýchkoli bisfosfonátů; látky snižující množství androgenů včetně analog GnRH, jakéhokoli kortikosteroidu, a 5-alfa reduktáz; inhibitory dráhy AR. BSoC nezahrnovala experimentální látky, cytotoxickou chemoterapii, imunoterapii, jiné systémové radioizotopy a léčbu polotělovým ozařováním.
Pacienti pokračovali v randomizované léčbě, dokud se neprokázala progrese nádoru (na základě hodnocení zkoušejícího dle kritérií pracovní skupiny 3 pro karcinom prostaty [PCWG3, Prostate Cancer Working Group 3]), nepřijatelná toxicita, použití zakázané léčby, non-compliance nebo vysazení, nebo nedostatek klinického přínosu.
Primárními cílovými parametry účinnosti byly celkové přežití (OS) a přežití bez radiografické progrese (rPFS), jak bylo stanoveno podle zaslepeného nezávislého centrálního hodnocení (BICR) s ohledem na kritéria PCWG3. Mezi sekundární cílové parametry patřily celkový výskyt odpovědi (ORR), jak bylo stanoveno podle BICR s ohledem na kritéria hodnocení odpovědi u solidních tumorů (RECIST, Response Evaluation Criteria in Solid Tumors) v1.1 a doba do první symptomatické kostní příhody (SSE) definovaná jako první nová symptomatická patologická zlomenina kosti, komprese míchy, ortopedický chirurgický zákrok související s nádorem, požadavek na radiační terapii ke zmírnění bolesti kostí nebo úmrtí z jakékoli příčiny, podle toho, co nastane dříve. Radiografické zobrazení pro hodnocení nádoru (kontrastní CT/MRI zobrazení a kostní sken) se provádělo každých 8 týdnů (± 4≥dny) po první dávce po dobu prvních 24 týdnů (nezávisle na zpoždění dávek), poté každých 12 tydnů (± 4 dny).
Demografické a výchozí charakteristiky onemocnění byly mezi léčebnými rameny vyvážené. Medián věku byl 71 let (rozmezí: 40 až 94 let); 86,8 % běloši; 6,6 % černoši nebo Afroameričané; 2,4 % Asiaté; 92,4 % mělo ECOG PS0-1; 7,6 % mělo ECOG PS2. Randomizace byla stratifikována podle výchozí hodnoty laktátdehydrogenázy (LDH ≤ 260 IU/l vs. > 260 IU/l), přítomnosti jaterních metastáz (ano vs. ne), ECOG PS skóre (0 nebo 1 vs. 2), a zahrnutí inhibitoru dráhy AR jako součást BSoC v době randomizace (ano vs. ne). Při randomizaci všichni pacienti (100,0 %) dostávali alespoň jeden předchozí chemoterapeutický režim na bázi taxanu a 41,2 % pacientů dostávalo dva; 97,1 % pacientů dostávalo docetaxel a 38,0 % pacientů dostávalo kabazitaxel. Při randomizaci 51,3 % pacientů dostalo jeden předchozí inhibitor dráhy AR, 41,0 % pacientů dostalo 2, a 7,7 % pacientů dostalo 3 nebo více. Během randomizované léčebné periody dostalo alespoň jeden inhibitor dráhy AR 52,6 % pacientů v rameni s přípravkem Pluvicto plus BSoC a 67,8 % pacientů v rameni se samotnou BSoC.
Výsledky účinnosti ve studii VISION jsou uvedeny v tabulce 3 a na obrázcích 1 a 2. Konečné analýzy OS a rPFS byly řízeny událostmi a provedeny po výskytu 530 úmrtí a 347 událostí.
Tabulka 3 Výsledky účinnosti ve studii VISION
| Parametry účinnosti | Pluvicto plus BSoC | BSoC |
| Alternativní primární cílové paramtery účinnosti | ||
| Celkové přežití (OS)a | n=551 | n=280 |
| Úmrtí, n (%) | 343 (62,3 %) | 187 (66,8 %) |
| Medián, měsíce (95% CI)b | 15,3 (14,2; 16,9) | 11,3 (9,8; 13,5) |
| Poměr rizik (95% CI)c | 0,62 (0,52; 0,74) | |
| p-hodnotad | < 0,001 | |
| Přežití bez radiografické progrese (rPFS)e,f | n=385 | n=196 |
| Události (progrese nebo úmrtí), n (%) | 254 (66,0 %) | 93 (47,4 %) |
| Radiografická progrese, n (%) | 171 (44,4 %) | 59 (30,1 %) |
| Úmrtí, n (%) | 83 (21,6 %) | 34 (17,3 %) |
| Medián, měsíce (99,2% CI)b | 8,7 (7,9; 10,8) | 3,4 (2,4; 4,0) |
| Poměr rizik (99,2% CI)c | 0,40 (0,29; 0,57) | |
| p-hodnotad | < 0,001 | |
| Sekundární cílové parametry účinnosti | ||
| Doba do první symptomatické kostní příhody (SSE)f | n=385 | n=196 |
| Událost (SSE nebo úmrtí), n (%) | 256 (66,5 %) | 137 (69,9 %) |
| SSEs, n (%) | 60 (15,6 %) | 34 (17,3 %) |
| Úmrtí, n (%) | 196 (50,9 %) | 103 (52,6 %) |
| Medián, měsíce (95% CI)b | 11,5 (10,3; 13,2) | 6,8 (5,2; 8,5) |
| Poměr rizik (95% CI)c | 0,50 (0,40; 0,62) | |
| p-hodnotag | < 0,001 | |
| Nejlepší celková odpověď (BOR) | ||
| Pacienti s vyhodnotitelným onemocněním na počátku | n=319 | n=120 |
| Kompletní odpověď (CR), n (%) | 18 (5,6 %) | 0 (0 %) |
| Parciální odpověď (PR), n (%) | 77 (24,1 %) | 2 (1,7 %) |
| Celkový výskyt odpovědi (ORR)h,i | 95 (29,8 %) | 2 (1,7 %) |
| p-hodnotaj | < 0,001 | |
| Délka odpovědi (DOR)h | ||
| Medián, měsíce (95% CI)b | 9,8 (9,1; 11,7) | 10,6 (NE; NE)k |
| BSoC: Nejlepší standardní péče; CI: Interval spolehlivosti; NE: Nehodnotitelné; BICR: Zaslepené nezávislé centrální hodnocení; PCWG3: Pracovní skupina 3 pro karcinom prostaty; RECIST: Kritéria hodnocení odpovědi u solidních tumorů. a Analyzováno na základě záměru léčit (ITT) u všech randomizovaných pacientů. b Na základě Kaplanova-Meierova odhadu. c Poměr rizik založený na stratifikovaném Coxově PH modelu. Poměr rizik < 1 favorizuje Pluvicto plus BSoC. d Stratifikovaný log-rank test jednostranné p-hodnoty. e Podle BICR s ohledem na PCWG3 kritéria. Primární analýza rPFS zahrnovala cenzorování pacientů, kteří měli ≥ 2 po sobě jdoucí zmeškané hodnocení nádoru bezprostředně před progresí nebo úmrtím. Výsledky pro rPFS s a bez cenzorování pro chybějící hodnocení byly konzistentní. f Analyzováno na základě ITT u všech pacientů randomizovaných 5. března 2019 nebo později, kdy byla provedena opatření ke zmírnění předčasného vyřazení z ramene s BSoC. g Stratifikovaný log-rank test oboustranné p-hodnoty. h Podle BICR s ohledem na RECIST v1.1. i ORR: CR+PR. Potvrzená odpověď pro CR a PR. j Stratifikovaný Waldův Chí kvadrát test oboustranné p-hodnoty. k Medián DOR v rameni se samotnou BSoC nebyl spolehlivý, protože pouze 1 ze 2 pacientů, kteří odpověděli, měl radiografickou progresi nebo došlo k úmrtí podle RECIST v1.1. |
||
Obrázek 1 Kaplanova-Meierova křivka OS ve studii VISION
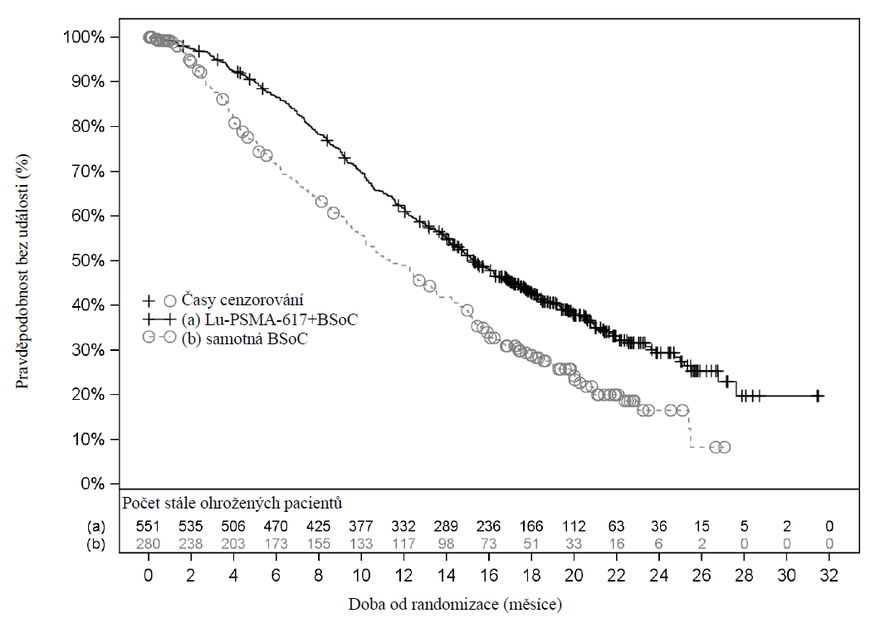
Stratifikovaný log-rank test a stratifikovaný Coxův model využívající strata podle Technologie interaktivní odezvy (IRT) definovaný hladinou LDH, přítomností jaterních metastáz, ECOG skórem a zahrnutím inhibitoru dráhy AR u BSoC v době randomizace.
n/n: Počet událostí/počet pacientů v léčebném rameni.
Obrázek 2 Kaplanova-Meierova křivka BICR hodnoceného rPFS ve studii VISION
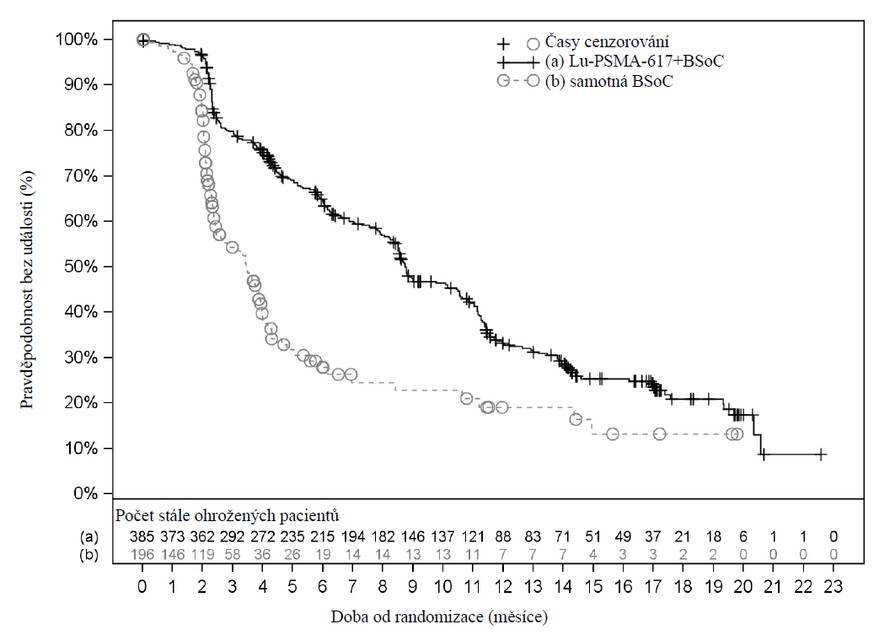
Stratifikovaný log-rank test a stratifikovaný Coxův model využívající strata podle IRT definovaný hladinou LDH, přítomností jaterních metastáz, skórem ECOG a zahrnutím inhibitoru dráhy AR u BSoC v době randomizace.
n/n: Počet událostí/počet pacientů v léčebném rameni.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Pluvicto u všech podskupin pediatrické populace v léčbě karcinomu prostaty exprimujícího PSMA (informace o použití u pediatrické populace viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika lutecia‑(177Lu) vipivotidu tetraxetanu byla charakterizována u 30 pacientů ve fázi III podstudie studie VISION.
Absorpce
Přípravek Pluvicto se podává intravenózně a je okamžitě a zcela biologicky dostupný.
Geometrický průměr krevní expozice (plocha pod křivkou [AUCinf]) lutecia‑(177Lu) vipivotidu tetraxetanu v doporučené dávce je 52,3 ng.h/ml (geometrický průměr variačního koeficientu [CV] 31,4 %). Geometrický průměr maximální koncentrace v krvi (Cmax) lutecia‑(177Lu) vipivotidu tetraxetanu je 6,58 ng/ml (CV 43,5 %).
Distribuce
Geometrický průměr distribučního objemu (Vz) lutecia‑(177Lu) vipivotidu tetraxetanu je 123 l (CV 78,1 %).
Neznačený vipivotid tetraxetan a neradioaktivní lutecium-(175Lu) vipivotid tetraxetan se z 60 % až 70 % váží na lidské plazmatické proteiny.
Vychytávání v orgánech
Biodistribuce lutecia‑(177Lu) vipivotidu tetraxetanu vykazuje primární uptake v lakrimálních žlázách, slinných žlázách, ledvinách, stěně močového měchýře, játrech, tenkém střevě a tlustém střevě (jeho levé a pravé části).
Eliminace
Geometrický průměr clearance (Cl) lutecia‑(177Lu) vipivotidu tetraxetanu je 2,04 l/h (CV 31,5 %).
Lutetium-(177Lu) vipivotid tetraxetan je primárně eliminován renální cestou.
Poločas rozpadu
Přípravek Pluvicto vykazuje biexponenciální eliminaci s geometrickým průměrem terminálního eliminačního poločasu (t½) 41,6 hodin (CV 68,8 %).
Biotransformace
Lutecium-(177Lu) vipivotid tetraxetan nepodléhá hepatálnímu ani renálnímu metabolismu.
Hodnocení potenciálu lékových interakcí in vitro
Enzymy CYP450
Vipivotid tetraxetan není substátem enzymů cytochromu P450 (CYP450). In vitro neindukuje cytochrom P450 (CYP) 1A2, 2B6 nebo 3A4, a neinhibuje cytochrom P450 (CYP) 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 nebo 3A4/5.
Transportéry
In vitro není vipivotid tetraxetan substrátem BCRP, P-gp, MATE1, MATE2-K, OAT1, OAT3 nebo OCT2, a není inhibitorem BCRP, P-gp, BSEP, MATE1, MATE2-K, OAT1, OAT3, OATP1B1, OATP1B3, OCT1 nebo OCT2.
Zvláštní populace
Vliv věku a tělesné hmotnosti
Žádné klinicky významné účinky na farmakokinetické parametry lutecia‑(177Lu) vipivotidu tetraxetanu nebyly identifikovány pro následující kovariáty hodnocené u 30 pacientů ve fázi III podstudie studie VISION: věk (medián: 67 let; rozmezí: 52 až 80 let) a tělesná hmotnost (medián: 88,8 kg; rozmezí: 63,8 až 143,0 kg).
Porucha funkce ledvin
Expozice (AUC) luteciu-(177Lu) vipivotidu tetraxetanu se zvýšila o 20 % u pacientů s lehkou poruchou funkce ledvin ve srovnání s normální funkcí ledvin. Poločas dozimetrie ledvin se také zvýšil u pacientů s lehkou poruchou funkce ledvin ve srovnání s normální funkcí ledvin, 51 hodin vs. 37 hodin, v tomto pořadí. U pacientů s lehkou nebo středně těžkou poruchou funkce ledvin může být vyšší riziko toxicity (viz bod 4.4). Nejsou k dispozici žádné údaje pro pacienty se středně těžkou až těžkou poruchou funkce ledvin s výchozí hodnotou Clcr < 50 ml/min nebo s onemocněním ledvin v terminálním stádiu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Žádné toxikologické účinky nebyly pozorovány ve farmakologických studiích bezpečnosti nebo ve studiích toxicity po jednorázové dávce u potkanů a miniprasat, kterým byla podána neradioaktivní formulace obsahující neznačený vipivotid tetraxetan a lutecium-(175Lu) vipivotid tetraxetan, ani ve studiích toxicity po opakovaném podání u potkanů, kterým byl podán neznačený vipivotid tetraxetan.
Kancerogenita a mutagenita
Studie mutagenity a dlouhodobé studie kancerogenity nebyly s luteciem-(177Lu) vipivotidem tetraxetanem provedeny; radiace je však kancerogen a mutagen.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Kyselina octová
Natrium-acetát
Kyselina gentisová
Natrium-askorbát
Kyselina pentetová
Voda pro injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodech 4.2 a 12.
6.3 Doba použitelnosti
120 hodin (5 dní) od data a času kalibrace
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před ionizujícím zářením (olověné stínění).
Uchovávání radiofarmak musí být v souladu s národními předpisy pro radioaktivní látky.
6.5 Druh obalu a obsah balení
Čirá, bezbarvá skleněná injekční lahvička třídy I, uzavřená bromobutylovou pryžovou zátkou a hliníkovým uzávěrem.
Každá injekční lahvička obsahuje objem roztoku, který se může pohybovat od 7,5 ml do 12,5 ml, což odpovídá radioaktivitě 7 400 MBq ± 10 % ke dni a času podání.
Injekční lahvička je uzavřena v olověném kontejneru pro ochranné stínění.
6.6 Zvláštní podmínky pro likvidaci přípravku a pro zacházení s ním
Obecné varování
Radiofarmaka mohou přijímat, používat a podávat pouze oprávněné osoby v určených klinických zařízeních. Jejich příjem, uchovávání, použití, přeprava a likvidace podléhají předpisům a/nebo příslušným licencím kompetentního úředního orgánu.
Radiofarmaka je nutné připravovat způsobem, který splňuje požadavky na radiační bezpečnost a zároveň farmaceutickou kvalitu. Je třeba přijmout odpovídající aseptická opatření.
Návod na přípravu léčivého přípravku před podáním je uveden v bodě 12.
Pokud je kdykoli při přípravě tohoto léčivého přípravku narušena integrita olověného kontejneru nebo injekční lahvičky, nesmí být přípravek použit.
Podání musí být provedeno tak, aby bylo riziko kontaminace léčivého přípravku a ozáření obsluhy minimální. Je nutné zajistit adekvátní stínění.
Podání radiofarmak představuje riziko pro ostatní osoby z externí radiace nebo na základě kontaminace z rozlité moči, zvracení, atd. Proto je třeba přijmout radioprotektivní opatření v souladu s národními předpisy.
Tento přípravek pravděpodobně povede k relativně vysoké dávce radiace u většiny pacientů. Podání přípravku Pluvicto může vést k významnému ohrožení životního prostředí. To se může týkat nejbližší rodiny osob podstupujících léčbu nebo široké veřejnosti v závislosti na úrovni podané aktivity. Mají být přijata vhodná opatření v souladu s národními předpisy ohledně aktivity eliminované pacienty, aby se zabránilo jakékoli kontaminaci.
Lutecium-177 pro přípravek Pluvicto lze připravit pomocí dvou různých zdrojů stabilních izotopů (buď lutecium-176 nebo ytterbium-176). Lutecium-177 pro přípravek Pluvicto připravený za použití stabilního izotopu lutecia‑176 („přidaný nosič“) vyžaduje zvláštní pozornost s ohledem na nakládání s odpady kvůli přítomnosti dlouhotrvající metastabilní nečistoty lutecia‑177 (177mLu) s poločasem rozpadu 160,4 dne. Lutecium-177 se pro přípravek Pluvicto připravuje s použitím ytterbia-176 („bez přidání nosiče“), pokud není uvedeno jinak na certifikátu šarže. Uživatel se musí před použitím přípravku Pluvicto seznámit s dodaným certifikátem o uvolnění šarže přípravku, aby bylo zajištěno náležité nakládání s odpady.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irsko
8. REGISTRAČNÍ ČÍSLO/REGISTRAČNÍ ČÍSLA
EU/1/22/1703/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
9. prosince 2022
10. DATUM REVIZE TEXTU
9. prosince 2022
11. DOZIMETRIE
Radiační dávka absorbovaná konkrétními orgány, které nemusí být cílovými orgány terapie, může být významně ovlivněna patofyziologickými změnami vyvolanými chorobným procesem. To je třeba vzít v úvahu při nakládání s uvedenými informacemi.
Dozimetrie lutecia‑(177Lu) vipivotidu tetraxetanu byla sesbírána od 29 pacientů ve fázi III podstudie studie VISION za účelem výpočtu dozimetrie záření celého těla a orgánů. Průměrné a standardní odchylky (SD) odhadovaných dávek absorbovaných různými orgány u dospělých pacientů, kteří dostávali přípravek Pluvicto, jsou uvedeny v tabulce 4. Orgány s nejvyššími absorbovanými dávkami jsou lakrimální a slinné žlázy.
Maximální penetrace lutecia‑177 do tkáně je přibližně 2 mm a střední hodnota penetrace je 0,67 mm.
Tabulka 4 Odhadované absorbované dávky pro přípravek Pluvicto v podstudii studie VISION
| Absorbovaná dávka na jednotku aktivity (mGy/MBq)a (n=29) |
Vypočtená absorbovaná dávka pro podání 7 400 MBq (Gy)a |
Vypočtená absorbovaná dávka pro 6 x 7 400 MBq (44 400 MBq kumulativní aktivita) (Gy)a |
||||
| Orgán | Průměr | SD | Průměr | SD | Průměr | SD |
| Nadledviny | 0,033 | 0,025 | 0,24 | 0,19 | 1,5 | 1,1 |
| Mozek | 0,007 | 0,005 | 0,049 | 0,035 | 0,30 | 0,22 |
| Oči | 0,022 | 0,024 | 0,16 | 0,18 | 0,99 | 1,1 |
| Stěna žlučníku | 0,028 | 0,026 | 0,20 | 0,19 | 1,2 | 1,1 |
| Srdeční stěna | 0,17 | 0,12 | 1,2 | 0,83 | 7,8 | 5,2 |
| Ledviny | 0,43 | 0,16 | 3,1 | 1,2 | 19 | 7,3 |
| Lakrimální žlázy | 2,1 | 0,47 | 15 | 3,4 | 92 | 21 |
| Levá část tlustého střeva | 0,58 | 0,14 | 4,1 | 1,0 | 26 | 6,0 |
| Játra | 0,090 | 0,044 | 0,64 | 0,32 | 4,0 | 2,0 |
| Plíce | 0,11 | 0,11 | 0,76 | 0,81 | 4,7 | 4,9 |
| Jícen | 0,025 | 0,026 | 0,18 | 0,19 | 1,1 | 1,1 |
| Osteogenní buňky | 0,036 | 0,028 | 0,26 | 0,21 | 1,6 | 1,3 |
| Pankreas | 0,027 | 0,026 | 0,19 | 0,19 | 1,2 | 1,1 |
| Prostata | 0,027 | 0,026 | 0,19 | 0,19 | 1,2 | 1,1 |
| Kostní dřeň | 0,035 | 0,020 | 0,25 | 0,15 | 1,5 | 0,90 |
| Rektum | 0,56 | 0,14 | 4,0 | 1,1 | 25 | 6,2 |
| Pravá část tlustého střeva | 0,32 | 0,078 | 2,3 | 0,58 | 14 | 3,4 |
| Slinné žlázy | 0,63 | 0,36 | 4,5 | 2,6 | 28 | 16 |
| Tenké střevo | 0,071 | 0,031 | 0,50 | 0,23 | 3,1 | 1,4 |
| Slezina | 0,067 | 0,027 | 0,48 | 0,20 | 3,0 | 1,2 |
| Stěna žaludku | 0,025 | 0,026 | 0,18 | 0,19 | 1,1 | 1,1 |
| Varlata | 0,023 | 0,025 | 0,16 | 0,18 | 1,0 | 1,1 |
| Thymus | 0,025 | 0,026 | 0,18 | 0,19 | 1,1 | 1,1 |
| Štítná žláza | 0,26 | 0,37 | 1,8 | 2,7 | 11 | 16 |
| Celé tělo | 0,037 | 0,027 | 0,27 | 0,20 | 1,6 | 1,2 |
| Stěna močového měchýře | 0,32 | 0,025 | 2,3 | 0,19 | 14 | 1,1 |
| Efektivní dávkab | 0,120 mSv/MBq |
0,043 mSv/MBq |
0,886 Sv |
0,315 Sv |
5,319 Sv |
1,892 Sv |
| a Odhady absorbované dávky byly odvozeny pomocí OLINDA v2.2. Hodnoty byly vypočteny na základě dozimetrických odhadů s plnou přesností a zaokrouhleny na relevantní číslice. b Odvozeno podle publikace ICRP 103. |
||||||
12. NÁVOD PRO PŘÍPRAVU RADIOFARMAK
Uživatel se musí před použitím přípravku Pluvicto seznámit s dodaným certifikátem uvolnění šarže přípravku, aby bylo zajištěno správné nakládání s odpady (viz bod 6.6).
Odběry mají být prováděny za aseptických podmínek. Injekční lahvičky nesmí být otevřeny před dezinfekcí, roztok má být natažen přes zátku pomocí jednodávkové injekční stříkačky opatřené vhodným protektivním stíněním a jednorázovou sterilní jehlou nebo pomocí autorizovaného automatického aplikačního systému.
Pokyny k přípravě
- Při manipulaci s přípravkem Pluvicto nebo při jeho podávání použijte aseptickou techniku a radiační stínění, současně za použití kleští, aby se minimalizovalo vystavení radiaci.
- Injekční lahvičku před podáním vizuálně zkontrolujte přes stínící obrazovku na přítomnost částic a změnu barvy. V případě přítomnosti částic a/nebo změny barvy injekční lahvičku zlikvidujte.
- Roztok přípravku Pluvicto neaplikujte přímo do žádného jiného intravenózního roztoku.
- Před a po podání přípravku Pluvicto potvrďte množství radioaktivity podané pacientovi pomocí vhodně kalibrovaného dávkového kalibrátoru.
Intravenózní způsoby podání
Pokyny pro injekční metodu (s nebo bez injekční pumpy)
- Po dezinfekci zátky injekční lahvičky nátáhněte vhodný objem roztoku přípravku Pluvicto k dodání požadované radioaktivity pomocí jednorázové injekční stříkačky opatřené stínícím krytem a jednorázové sterilní jehly.
- Přípravek Pluvicto podávejte pacientovi pomalým intravenózním tlakem během přibližně 1 až 10 minut (buď za použití injekční pumpy, nebo manuálně bez injekční pumpy) pomocí intravenózního katetru, který je předplněn sterilním injekčním roztokem chloridu sodného o koncentraci 9 mg/ml (0,9%) a který se používá výhradně pro podání přípravku Pluvicto pacientovi.
- Jakmile pacientovi podáte požadovanou radioaktivitu přípravku Pluvicto, proveďte intravenózní výplach ≥10 ml sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%) intravenózním katetrem.
Pokyny pro metodu gravitační infuze (s nebo bez infuzní pumpy)
- Vpíchněte 2,5cm jehlu velikosti 20 gauge (krátká jehla) do injekční lahvičky přípravku Pluvicto a připojte ji pomocí katetru k 500 ml sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%) (používá se k transportu roztoku přípravku Pluvicto během infuze). Zajistěte, aby se krátká jehla nedotýkala roztoku přípravku Pluvicto v injekční lahvičce a nepřipojujte krátkou jehlu přímo k pacientovi. Nenechte sterilní injekční roztok chloridu sodného o koncentraci 9 mg/ml (0,9%) téci do injekční lahvičky přípravku Pluvicto před zahájením jeho infuze a nevstřikujte roztok přípravku Pluvicto přímo do sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%).
- Do injekční lahvičky přípravku Pluvicto vložte druhou jehlu o délce 9 cm, velikost 18 gauge (dlouhá jehla) a při tom zajistěte, aby se dlouhá jehla po celou dobu infuze přímo dotýkala dna injekční lahvičky přípravku Pluvicto. Připojte dlouhou jehlu k pacientovi pomocí intravenózního katetru, který je předplněn sterilním injekčním roztokem chloridu sodného o koncentraci 9 mg/ml (0,9%) a který se používá výhradně pro podání infuze přípravku Pluvicto pacientovi.
- Pomocí svorky nebo infuzní pumpy regulujte průtok sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%) krátkou jehlou do injekční lahvičky přípravku Pluvicto (sterilní injekční roztok chloridu sodného o koncentraci 9 mg/ml (0,9%) vstupující do injekční lahvičky krátkou jehlou přenese roztok přípravku Pluvicto z injekční lahvičky k pacientovi pomocí intravenózního katetru připojeného k dlouhé jehle během přibližně 30 minut).
- Během infuze zajistěte, aby hladina roztoku v injekční lahvičce přípravku Pluvicto zůstala konstantní.
- Odpojte injekční lahvičku od dlouhé jehly a zasvorkujte přívod chloridu sodného jakmile bude hladina radioaktivity stabilní alespoň po dobu pěti minut.
- Po infuzi pokračujte intravenózním propláchnutím ≥ 10 ml sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%) intravenózním katetrem připojeným k pacientovi.
Pokyny pro metodu infuze s pomocí injekční lahvičky (s peristaltickou infuzní pumpou)
- Vložte 2,5cm jehlu velikosti 20 gauge (krátká odvětrávací jehla) do injekční lahvičky přípravku Pluvicto. Zajistěte, aby se krátká jehla nedotýkala roztoku přípravku Pluvicto v injekční lahvičce a nepřipojujte krátkou jehlu přímo k pacientovi nebo k peristaltické infuzní pumpě.
- Do injekční lahvičky přípravku Pluvicto vložte druhou jehlu o délce 9 cm, velikost 18 gauge (dlouhá jehla) a při tom zajistěte, aby se dlouhá jehla po celou dobu infuze přímo dotýkala dna injekční lahvičky přípravku Pluvicto. Připojte dlouhou jehlu a sterilní injekční roztok chloridu sodného o koncentraci 9 mg/ml (0,9%) k trojcestnému uzavíracímu ventilu pomocí vhodné hadičky.
- Připojte výstup trojcestného uzavíracího ventilu k hadičce instalované na vstupní straně peristaltické infuzní pumpy podle pokynů výrobce pumpy.
- Předplňte hadičku otevřením trojcestného uzavíracího ventilu a čerpáním roztoku přípravku Pluvicto systémem hadiček, dokud roztok nedosáhne výstupu z ventilu.
- Předplňte intravenózní katetr, který bude připojen k pacientovi, otevřením trojcestného uzavíracího ventilu sterilnímu injekčnímu roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%) a čerpáním sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9%), dokud roztok neopustí hadičky katetru.
- Připojte předplněný intravenózní katetr k pacientovi a nastavte trojcestný uzavírací ventil tak, aby byl roztok přípravku Pluvicto v linii s peristaltickou infuzní pumpou.
- Aplikujte vhodný objem roztoku přípravku Pluvicto rychlostí přibližně 25 ml/h k dodání požadované radioaktivity.
- Po podání požadované radioaktivity přípravku zastavte peristaltickou infuzní pumpu a poté změňte polohu trojcestného uzavíracího ventilu, aby peristaltická infuzní pumpa byla v linii se sterilním injekčním roztokem chloridu sodného o koncentraci 9 mg/ml (0,9%). Restartujte peristaltickou infuzní pumpu a proveďte intravenózní výplach ≥10 ml sterilního injekčního roztoku chloridu sodného intravenózním katetrem, který je připojen k pacientovi.
Kontrola kvality
Roztok musí být před použitím vizuálně zkontrolován, zda není poškozen a kontaminován, a smí být použity pouze čiré roztoky bez viditelných částic. Vizuální kontrola roztoku má být pro účely radioprotekce provedena přes stínící obrazovku. Injekční lahvička se nesmí otevírat.
Pokud je kdykoli při přípravě tohoto léčivého přípravku narušena integrita olověného kontejneru nebo injekční lahvičky, nesmí být přípravek použit.
Množství radioaktivity v injekční lahvičce musí být změřeno před podáním pomocí vhodného kalibračního systému radioaktivity, aby se potvrdilo, že skutečné množství radioaktivity, které má být podáno, se rovná plánovanému množství v době podání.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky https://www.ema.europa.eu
Zkrácená informace o přípravku v pdf →