Přípravek Pluvicto® – terapie radioligandem cílená na PSMA*,1,2
Dodává terapeutické záření, které poškozuje DNA, přímo do metastáz s PSMA pozitivním nálezem; jsou to kostní, uzlinové a viscerální metastázy1,3‑5
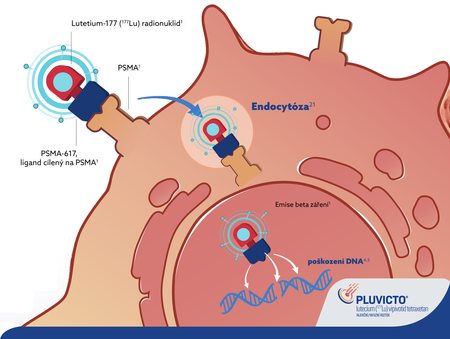
PSMA: transmembránový glykoprotein6
- Nadměrně exprimován na povrchu buněk karcinomu prostaty u > 80 % pacientů s mCRPC2,7,8
- Včetně metastáz v kostech, mízních uzlinách a viscerálních metastáz9‑13
Vysoce specifická vazba na PSMA1,14‑17
- Krátký dosah beta záření s maximální penetrací cca 2 mm1,18
- Limitované vedlejší off target účinky1,15‑17
- Účinná aplikace záření do nádorové buňky1,15‑17
* Přípravek Pluvicto® v kombinaci s androgen-deprivační terapií (ADT) s nebo bez inhibice dráhy androgenního receptoru (AR) je indikován k léčbě dospělých pacientů s progresivním metastazujícícm kastračně rezistentním karcinomem prostaty (mCRPC) pozitivním na prostatický specifický membránový antigen (PSMA), kteří byli léčeni inhibicí dráhy AR a chemoterapií na bázi taxanů.1
Zobrazení pomocí metody PSMA PET umožní rozpoznat a cílit na PSMA pozitivní mCRPC9‑11, 15

Díky vysoké senzitivitě PSMA PET zobrazení lze detekovat metastázy v kostech, uzlinách nebo viscerální metastázy9‑13

Pomocí PSMA PET lze posoudit způsobilost pacienta k terapii radioligandem cílenou na PSMA2,15

Použité zkratky
ADT – androgen-deprivační terapie;
AR – androgenní receptory;
mCRPC – metastatický kastračně rezistentní karcinom prostaty;
PSMA – prostatický specifický membránový antigen
Literatura
- Souhrn údajů o přípravku PLUVICTO®, datum poslední revize 9.12.2022, https://sukl.gov.cz/.
- Sartor O, et al. N Engl J Med. 2021 Sep;385(12):1091–1103.
- Boyd M, et al. Gene Ther. 1999 Jun;6(6):1147–1152.
- Ruigrok EAM, et al. Eur J Nucl Med Mol Imaging. 2021 May;48(5):1339–1350.
- Fendler WP, et al. J Nucl Med. 2017 Nov;58(11):1786–1792.
- Israeli RS, et al. Cancer Res. 1993 Jan 15;53(2):227-30.
- Sartor O, et al. N Engl J Med. 2021 Sep;385(12):1091–1103. Supplementary appendix.
- Hupe MC, et al. Front Oncol. 2018 Dec 20;8:623.
- Dorff TB, et al. Am Soc Clin Oncol Educ Book. 2019 Jan;39:321-330.
- Maffey-Steffan J, et al. Eur J Nucl Med Mol Imaging. 2020 Mar;47(3):695–712.
- Vlachostergios PJ, et al. Front Oncol. 2021 Feb;11:630589.
- Woythal N, et al. J Nucl Med. 2018 Feb;59(2):238–243.
- Schmuck S, et al. J Nucl Med. 2017 Dec;58(12):1962–1968.
- Benešová M, et al. J Nucl Med. 2015 Jun;56(6):914–920.
- Hofman MS, et al. Lancet Oncol. 2018 Jun;19(6):825–833.
- Kratochwil C, et al. J Nucl Med. 2016 Aug;57(8):1170–1076.
- Violet J, et al. J Nucl Med. 2019 Apr;60(4):517–523.
- Pouget JP, et al. Front Med (Lausanne). 2015 Mar;2:12.
- Ferdinandus J, et al. Curr Opin Urol. 2018 Mar;28(2):197–204.
- Kassis AI. Semin Nucl Med. 2008 Sep;38(5):358-66.
- Bouchelouche K, et al. Discov Med. 2010 Jan;9(44):55-61.
- Hope TA, et al. J Nucl Med. 2017 Dec;58(12):1956-1961.
