1. NÁZEV PŘÍPRAVKU
Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce
Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce
Cosentyx 150 mg injekční roztok v předplněném peru
Cosentyx 300 mg injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje sekukinumabum 150 mg v 1 ml.
Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje sekukinumabum 300 mg ve 2 ml.
Cosentyx 150 mg injekční roztok v předplněném peru
Jedno předplněné pero obsahuje sekukinumabum 150 mg v 1 ml.
Cosentyx 300 mg injekční roztok v předplněném peru
Jedno předplněné pero obsahuje sekukinumabum 300 mg ve 2 ml.
Sekukinumab je rekombinantní plně humánní monoklonální protilátka produkovaná v buňkách ovarií čínského křečíka (CHO).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce)
Roztok je čirý a bezbarvý až mírně nažloutlý.
4. KLINICKÉ ÚDAJE
-
4.1 Terapeutické indikace
-
Ložisková psoriáza u dospělých
Přípravek Cosentyx je indikován k léčbě středně těžké až těžké ložiskové psoriázy dospělých, kteří jsou kandidáty pro systémovou léčbu.
-
Ložisková psoriáza u pediatrické populace
Přípravek Cosentyx je indikován k léčbě středně těžké až těžké ložiskové psoriázy u dospívajících a dětí od 6 let, kteří jsou kandidáty pro systémovou léčbu.
-
Hidradenitida (HS, hidradenitis suppurativa)
Přípravek Cosentyx je indikován k léčbě aktivní středně těžké až těžké hidradenitidy (acne inversa) u dospělých s nedostatečnou odpovědí na konvenční systémovou HS terapii (viz bod 5.1).
-
Psoriatická artritida
Přípravek Cosentyx, samotný nebo v kombinaci s metotrexátem (MTX), je indikován k léčbě aktivní psoriatické artritidy u dospělých pacientů, u nichž se nedostavila adekvátní odpověď na předchozí léčbu chorobu modifikujícími antirevmatiky (DMARD) (viz bod 5.1).
-
Axiální spondylartritida (axSpA)
Ankylozující spondylitida (AS, radiografická axiální spondylartritida)
Přípravek Cosentyx je indikován k léčbě aktivní ankylozující spondylitidy u dospělých, kteří nedostatečně reagovali na konvenční léčbu.Non-radiografická axiální spondylartritida (nr-axSpA)
Cosentyx je indikován k léčbě aktivní non-radiografické axiální spondylartritidy s objektivními známkami zánětu indikovanými zvýšeným C-reaktivním proteinem (CRP) a/nebo zobrazením magnetickou rezonancí (MRI) u dospělých, kteří neodpovídají adekvátně na nesteroidní protizánětlivá léčiva (NSAID).
-
Juvenilní idiopatická artritida
Artritida související s entezitidou (ERA)
Přípravek Cosentyx samotný nebo v kombinaci s methotrexátem (MTX) je indikován k léčbě aktivní artritidy související s entezitidou u pacientů od 6 let, kteří nedostatečně odpovídají na konvenční terapii nebo ji netolerují (viz bod 5.1).Juvenilní psoriatická artritida (JPsA)
Přípravek Cosentyx samotný nebo v kombinaci s methotrexátem (MTX) je indikován k léčbě aktivní juvenilní psoriatické artritidy u pacientů od 6 let, kteří nedostatečně odpovídají na konvenční terapii nebo ji netolerují (viz bod 5.1).
-
-
4.2 Dávkování a způsob podání
Přípravek Cosentyx je určen k použití pod vedením a dohledem lékaře obeznámeného s diagnostikou a léčbou stavů, u nichž je přípravek Cosentyx indikován.
-
Dávkování
Ložisková psoriáza u dospělých
Doporučená dávka je 300 mg sekukinumabu ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Na základě klinické odpovědi může udržovací dávka 300 mg každé 2 týdny poskytnout další přínos pro pacienty s tělesnou hmotností 90 kg nebo vyšší. Každá dávka 300 mg se podává v jedné subkutánní injekci obsahující 300 mg nebo ve dvou dílčích subkutánních injekcích po 150 mg.Ložisková psoriáza u pediatrické populace (dospívající a děti od 6 let)
Doporučená dávka se odvíjí od tělesné hmotnosti (tabulka 1) a podává se ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Každá dávka 75 mg se podává jako jedna subkutánní injekce obsahující 75 mg. Každá dávka 150 mg se podává jako jedna subkutánní injekce obsahující 150 mg. Každá dávka 300 mg se podává v jedné subkutánní injekci obsahující 300 mg nebo ve dvou dílčích subkutánních injekcích po 150 mg.Tabulka 1 Doporučená dávka pro pediatrické pacienty s ložiskovou psoriázou
Těšlesná hmotnost v době podání Doporučená dávka <25 kg 75 mg 25 až <50 kg 75 mg ≥50 kg 150 mg (*může být zvýšena na 300 mg) *U některých pacientů může vyšší dávka znamenat větší prospěch.
Injekční roztok v předplněné injekční stříkačce a v předplněném injekčním peru s dávkou 150 mg a 300 mg není určen k podávání dětským pacientům s hmotností <50 kg. Cosentyx může být dostupný v jiných silách a/nebo prezentacích na základě individuálních potřeb léčby.
Hidradenitida (HS)
Doporučená dávka je 300 mg sekukinumabu ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Na základě klinické odpovědi může být dávka zvýšena na 300 mg každé 2 týdny. Každá dávka 300 mg se podává v jedné subkutánní injekci obsahující 300 mg nebo ve dvou dílčích subkutánních injekcích po 150 mg.Psoriatická artritida
U pacientů se současně přítomnou středně těžkou až těžkou ložiskovou psoriázou viz doporučení pro ložiskovou psoriázu pro dospělé.U pacientů nedostatečně odpovídajících na anti-TNFα (IR), je doporučená dávka 300 mg ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Každá dávka 300 mg se podává v jedné subkutánní injekci obsahující 300 mg nebo ve dvou dílčích subkutánních injekcích po 150 mg.
U ostatních pacientů je doporučená dávka 150 mg ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Dávka může být zvýšena na 300 mg na základě klinické odpovědi.
Axiální spondylartritida (axSpA)
Ankylozující spondylitida (AS, radiografická axiální spondylartritida)
Doporučená dávka je 150 mg ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Dávka může být zvýšena na 300 mg na základě klinické odpovědi. Každá dávka 300 mg se podává v jedné subkutánní injekci obsahující 300 mg nebo ve dvou dílčích subkutánních injekcích po 150 mg.Non-radiografická axiální spondylartritida (nr-axSpA) Doporučená dávka je 150 mg ve formě subkutánní injekce s iniciálním podáním v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou.
Juvenilní idiopatická artritida
Artritida související s entezitidou (ERA) a juvenilní psoriatická artritida (JPsA)
Doporučená dávka se odvíjí od tělesné hmotnosti (tabulka 2) a podává se ve formě subkutánní injekce v týdnech 0, 1, 2, 3 a 4, následovaná měsíční udržovací dávkou. Každá dávka 75 mg se podává jako jedna subkutánní injekce obsahující 75 mg. Každá dávka 150 mg se podává jako jedna subkutánní injekce obsahující 150 mg.Tabulka 2 Doporučená dávka pro juvenilní idiopatickou artritidu
Tělesná hmotnost v době podání Doporučená dávka <50 kg 75 mg ≥50 kg 150 mg Injekční roztok v předplněné injekční stříkačce a v předplněném injekčním peru s dávkou 150 mg a 300 mg není určen k podávání dětským pacientům s hmotností <50 kg. Cosentyx může být dostupný v jiných silách a/nebo prezentacích na základě individuálních potřeb léčby.
Dostupná data naznačují, že klinická odpověď ve všech shora uvedených indikacích se obvykle dostaví během 16 týdnů. U pacientů, u nichž se do 16. týdne nedostaví žádná terapeutická odpověď, je nutné zvážit ukončení léčby. U některých pacientů s počáteční částečnou odpovědí může dojít k následnému zlepšení při pokračování léčby nad 16 týdnů.
-
Zvláštní populace
Starší pacienti (ve věku 65 let a více)
Není nutná úprava dávky (viz bod 5.2).Porucha funkce ledvin / Porucha funkce jater
Přípravek Cosentyx nebyl u těchto pacientských populací studován. Nelze učinit žádná doporučení ohledně dávkování.Pediatrická populace
Bezpečnost a účinnost přípravku Cosentyx u dětí mladších než 6 let s ložiskovou psoriázou a s juvenilní idiopatickou artritidou (JIA) typu ERA a JPsA nebyla stanovena.Bezpečnost a účinnost přípravku Cosentyx u dětí ve věku do 18 let v jiných indikacích nebyla dosud stanovena. Nejsou dostupné žádné údaje.
-
Způsob podání
Přípravek Cosentyx je určen k podání ve formě subkutánní injekce. Pokud je to možné, oblasti pokožky s projevy psoriázy nemají být použity k podání injekce. S injekční stříkačkou nebo perem netřepejte.
Po vhodném nácviku subkutánní injekční techniky, si může pacient sám aplikovat přípravek Cosentyx nebo může být podán opatrovníkem, pokud to lékař uzná za vhodné. Lékař však musí zajistit přiměřené sledování pacientů. Pacienti nebo opatrovníci musí být instruováni injikovat celé množství přípravku Cosentyx podle instrukcí v příbalové informaci. Kompletní informace o podávání jsou uvedeny v příbalové informaci.
-
-
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Klinicky významné aktivní infekce (např. aktivní tuberkulóza; viz bod 4.4).
-
4.4 Zvláštní upozornění a opatření pro použití
-
Sledovatelnost
Za účelem zlepšení sledovatelnosti biologických léčivých přípravků je nutné pečlivě zaznamenat název a číslo šarže podaného přípravku.
-
Infekce
Sekukinumab má potenciál zvyšovat riziko infekcí. Po uvedení přípravku na trh byly u pacientů léčených sekukinumabem pozorovány závažné infekce. Opatrnosti je zapotřebí, pokud se uvažuje o použití sekukinumabu u pacientů s chronickou infekcí nebo opakovanou infekcí v anamnéze.
Pacienty je nutné poučit, aby vyhledali lékařskou pomoc, pokud se objeví známky nebo příznaky naznačující přítomnost infekce. Pokud se u pacienta rozvine závažná infekce, je nutné pacienta pečlivě sledovat a nepodávat sekukinumab, dokud infekce neodezní.
V klinických studiích byly u pacientů léčených sekukinumabem infekce pozorovány (viz bod 4.8). Většina z nich byly mírně nebo středně závažné infekce horních cest dýchacích jako nasopharyngitis a nevyžadovaly přerušení léčby.
V souladu s mechanizmem účinku sekukinumabu byly u sekukinumabu v porovnání s placebem v klinických studiích s psoriázou mnohem častěji hlášeny nezávažné mukokutánní kandidové infekce (3,55 na 100 pacientoroků u sekukinumabu 300 mg versus 1,00 na 100 pacientoroků u placeba) (viz bod 4.8).
-
Tuberkulóza
U pacientů léčených sekukinumabem byla hlášena tuberkulóza (aktivní a/nebo reaktivace latentní tuberkulózy). Před zahájením léčby sekukinumabem je třeba pacienty vyšetřit na přítomnost tuberkulózy. Sekukinumab nesmí být podáván pacientům s aktivní tuberkulózou (viz bod 4.3). U pacientů s latentní tuberkulózou je nutné zvážit před zahájením léčby sekukinumabem zvážit antituberkulózní léčbu v souladu s klinickými doporučeními. Pacienti, kterým je podáván sekukinumab, mají být sledováni s ohledem na známky a příznaky aktivní tuberkulózy.
-
Zánětlivá onemocnění střev (včetně Crohnovy choroby a ulcerózní kolitidy)
U sekukinumabu byly hlášeny nové případy nebo exacerbace zánětlivých onemocnění střev (viz bod 4.8). Sekukinumab se nedoporučuje u pacientů se zánětlivým onemocněním střev. Pokud se u pacienta objeví známky a příznaky zánětlivého onemocnění střev nebo dojde-li k exacerbaci již existujícího zánětlivého onemocnění střev, je třeba sekukinumab vysadit a zahájit odpovídající lékařskou péči.
-
Hypersenzitivní reakce
U pacientů léčených sekukinumabem byly vzácně pozorovány případy anafylaktických reakcí a angioedém. Pokud se objeví anafylaktická reakce, angioedém nebo jiné závažné alergické reakce, musí se podávání sekukinumabu okamžitě přerušit a zahájit vhodná léčba.
-
Osoby citlivé na latex – pouze Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce a 150 mg injekční roztok v předplněném peru
Snímatelný kryt jehly přípravku Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce a přípravku Cosentyx 150 mg injekční roztok v předplněném peru obsahuje derivát přirozeně se vyskytujícího gumového latexu. Ve snímatelném krytu jehly nebyl dosud detekován přirozeně se vyskytující gumový latex. Nicméně použití přípravku Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce a přípravku Cosentyx 150 mg injekční roztok v předplněném peru u osob citlivých na latex nebylo studováno a proto nelze možné riziko hypersenzitivních reakcí zcela vyloučit.
-
Očkování
Živé vakcíny nesmí být podávány současně se sekukinumabem.
Pacienti léčení sekukinumabem mohou současně absolvovat současné očkování inaktivovanými nebo neživými vakcínami. Ve studii po podání meningokokové a inaktivované chřipkové vakcíny, byla podobná část zdravých dobrovolníků léčených 150 mg sekukinumabu a těch léčených placebem schopna dosáhnout adekvátní imunitní odpovědi nejméně 4násobného zvýšení titru protilátek při meningokokové a chřipkové vakcíně. Tyto údaje naznačují, že sekukinumab nepotlačuje látkovou imunitní odpověď na meningokokovou nebo chřipkovou vakcínu.
Před zahájením léčby přípravkem Cosentyx se doporučuje, aby byla u pediatrických pacientů provedena všechna věku odpovídající očkování podle současných pokynů pro očkování.
-
Současná imunosupresivní léčba
Ve studiích s psoriázou nebyly bezpečnost a účinnost sekukinumabu v kombinaci s imunosupresivy, včetně biologické léčby, nebo fototerapií vyhodnocovány. Sekukinumab byl podáván ve studiích artritidy současně s methotrexátem (MTX), sulfasalazinem a/nebo kortikosteroidy (včetně pacientů s psoriatickou artritidou a ankylozující spondylitidou). Pokud se zvažuje současné podání sekukinumabu a jiných imunosupresiv, je nutná obezřetnost (viz též bod 4.5)
-
Reaktivace hepatitidy B
U pacientů léčených sekukinumabem může dojít k reaktivaci hepatitidy B. V souladu s klinickými doporučeními pro imunosupresiva je třeba před zahájením léčby sekukinumabem zvážit testování pacientů na infekci HBV. U pacientů s pozitivní sérologií HBV mají být během léčby sekukinumabem sledovány klinické a laboratorní známky reaktivace HBV. Pokud dojde během léčby sekukinumabem k reaktivaci HBV, je třeba zvážit přerušení léčby a pacienty léčit podle klinických doporučení.
-
-
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Živé vakcíny nesmí být podávány současně se sekukinumabem (viz též bod 4.4).
Ve studii u dospělých subjektů s ložiskovou psoriázou nebyly pozorovány interakce mezi sekukinumabem a midazolamem (substrát CYP3A4).
Při současném podávání sekukinumabu s methotrexátem (MTX) a/nebo s kortikosteroidy nebyly v artritických studiích (včetně pacientů s psoriatickou artritidou a axiální spondylartritidou) pozorovány žádné interakce.
-
4.6 Fertilita, těhotenství a kojení
-
Ženy ve fertilním věku
Ženy ve fertilním věku musí během léčby a ještě nejméně 20 týdnů po ukončení terapie používat účinnou antikoncepci.
-
Těhotenství
Odpovídající údaje o podávání sekukinumabu těhotným ženám nejsou k dispozici.
Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3). Podávání přípravku Cosentyx v těhotenství se z preventivních důvodů nedoporučuje.
-
Kojení
Není známo, zda se sekukinumab vylučuje do lidského mateřského mléka. Imunoglobuliny se do lidského mateřského mléka vylučují a není známo, zda se sekukinumab po požití absorbuje systémově. Vzhledem k možným nežádoucím účinkům sekukinumabu na kojené dítě je nutno na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku rozhodnout, zda během léčby a po dobu až 20 týdnů od ukončení léčby přerušit kojení nebo přerušit léčbu sekukinumabem.
-
Fertilita
Vliv sekukinumabu na fertilitu u člověka nebyl hodnocen. Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky na fertilitu.
-
-
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Cosentyx nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
-
4.8 Nežádoucí účinky
-
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky jsou infekce horních cest dýchacích (17,7 %) (nejčastěji nasofaryngitida, rinitida).
-
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky z klinických studií a z postmarketinkových hlášení (tabulka 3) jsou řazeny podle tříd orgánových systémů MedDRA. V každé třídě orgánových systémů jsou nežádoucí účinky řazeny podle frekvence, přičemž nejčastější nežádoucí účinky jsou uvedeny jako první. V rámci každé skupiny četnosti jsou nežádoucí účinky řazeny podle klesající závažnosti. Navíc jsou odpovídající frekvenční kategorie pro všechny nežádoucí účinky založeny na následující konvenci: velmi časté (≥1/10); časté (≥1/100 až <1/10); méně časté (≥1/1 000 až <1/100); vzácné (≥1/1 0000 až <1/1 000); velmi vzácné (<1/10 000); a není známo (z dostupných údajů nelze určit).
Sekukinumabem bylo léčeno více než 20 000 pacientů v zaslepených a otevřených klinických studiích s různými indikacemi (ložisková psoriáza, psoriatická artritida, axiální spondylartritida, hidradenitida a jiné autoimunitní stavy), představující expozici 34 908 pacientoroků. Z tohoto počtu bylo přes 14 000 pacientů exponováno sekukinumabu po dobu nejméně jednoho roku. Bezpečnostní profil sekukinumabu je konzistentní napříč indikacemi.
Tabulka 3 Přehled nežádoucích účinků z klinických studií1) a z postmarketinkových hlášení
Třídy orgánových systémů
Frekvence
Nežádoucí účinek
Infekce a infestace
Velmi časté
Infekce horních cest dýchacích
Časté
Orální herpes
Méně časté
Orální kandidóza
Otitis externa
Infekce dolních cest dýchacích
Tinea pedis
Není známo
Mukózní a kožní kandidóza (včetně ezofageální kandidózy)
Poruchy krve a lymfatického systému
Méně časté
Neutropenie
Poruchy imunitního systému
Vzácné
Anafylaktické reakce
Angioedém
Poruchy nervového systému
Časté
Bolest hlavy
Poruchy oka
Méně časté
Konjunktivitida
Respirační, hrudní a mediastinální poruchy
Časté
Rinorea
Gastrointestinální poruchy
Časté
Diarhea
Nauzea
Méně částé
Zánětlivé střevní onemocnění
Poruchy kůže a podkožní tkáně
Časté
Ekzém
Méně časté
Urtikarie
Dyshidrotický ekzém
Vzácné
Exfoliativní dermatitida 2)
Hypersenzitivní vaskulitida
Není známo
Pyoderma gangraenosum
Celkové poruchy a reakce v místě aplikace
Časté
Únava
1) Placebem kontrolované klinické studie (fáze III) u pacientů s ložiskovou psoriázou, s PsA, AS, nr-axSpA a HS exponovaných dávkám 300 mg, 150 mg nebo placebu s dobou léčby až 12 týdnů (psoriáza) nebo 16 týdnů (PsA, AS, nr-axSpA a HS).
2) Byla hlášena u pacientů s psoriázou.
-
Popis vybraných nežádoucích účinků
Infekce
V placebem kontrolovaném období klinických studií s ložiskovou psoriázou (celkem 1 382 pacientů léčených sekukinumabem a 694 pacientů na placebu po dobu až 12 týdnů), byly infekce hlášeny u 28,7 % pacientů léčených sekukinumabem v porovnání se 18,9 % pacientů na placebu. Většinu infekcí tvořily nezávažné až mírné infekce horních cest dýchacích, jako je nasofaryngitida, které nevyžadovaly přerušení léčby. Objevil se nárůst mukózních nebo kožních kandidóz, konzistentních s mechanizmem účinku, jednalo se však o případy mírné nebo střední závažnosti, nezávažné, reagující na standardní léčbu a nevyžadující přerušení léčby. Závažné infekce se objevily u 0,14 % pacientů léčených sekukinumabem a 0,3 % u pacientů na placebu (viz bod 4.4).Během celé léčebné periody (celkem 3 430 léčených sekukinumabem po dobu až 52 týdnů u většiny pacientů) byly infekce hlášeny u 47,5 % pacientů léčených sekukinumabem (0,9 na pacientorok dalšího sledování). Závažné infekce byly hlášeny u 1,2 % pacientů léčených sekukinumabem (0,015 na pacientorok dalšího sledování).
Počet infekcí pozorovaných ve studiích psoriatické artritidy a axiální spondylartritidy (ankylozující spondylitida a non-radiografická axiální spondylartritida) byl podobný počtu infekcí pozorovaných u psoriatických studií.
Pacienti s hidradenitidou jsou více náchylní k infekcím. V placebem kontrolované části klinických studií s hidradenitidou (celkem 721 pacientů léčených sekukinumabem a 363 pacientů léčených placebem po dobu až 16 týdnů) byl výskyt infekcí numericky vyšší než výskyt infekcí ve studiích s psoriázou (30,7 % pacientů léčených sekukinumabem ve srovnání s 31,7 % pacienty léčenými placebem). Většina z nich byla nezávažná, mírně nebo středně závažná a nevyžadovala přerušení nebo ukončení léčby.
Neutropenie
V klinických studiích fáze III u psoriázy byla neutropenie mnohem častěji pozorována u sekukinumabu než u placeba, nicméně většina případů byla mírná, přechodná a reversibilní. Neutropenie <1,0‑0,5x109/l (CTCAE stupeň 3) byla hlášena u 18 z 3430 (0,5 %) pacientů léčených sekukinumabem, bez závislosti na dávce a bez časové souvislosti s infekcí u 15 z 18 případů. Případy závažnější neutropenie nebyly. Nezávažné infekce s obvyklou odpovědí na standardní léčbu a nevyžadující přerušení léčby sekukinumabem byly hlášeny ve zbývajících 3 případech.Frekvence výskytu neutropenie u psoriatické artritidy, axiální spondylartritidy (ankylozující spondylitida a non-radiografická axiální spondylartritida) a hidradenitidy byla podobná jako u psoriázy.
Byly hlášeny vzácné případy neutropenie <0,5x109/l (CTCAE stupeň 4).
Imunogenita
V klinických studiích u psoriázy, psoriatické artritidy, axiální spondylartritidy (ankylozující spondylitida a non-radiografická axiální spondylartritida) a hidradenitidy si méně než 1 % pacientů léčených sekukinumabem vyvinulo protilátky proti sekukinumabu po dobu až 52 týdnů léčby. Zhruba polovina protilátek objevivších se v souvislosti s léčbou byla neutralizujících, nicméně to nebylo spojeno se ztrátou účinnosti nebo farmakokinetickými abnormalitami.
-
Pediatrická populace
Nežádoucí účinky u pediatrických pacientů ve věku od 6 let s ložiskovou psoriázou
Bezpečnost sekukinumabu byla hodnocena ve dvou studiích fáze III u pediatrických pacientů s ložiskovou psoriázou. První studie (pediatrická studie 1) byla dvojitě zaslepená, placebem kontrolovaná studie se 162 pacienty ve věku od 6 do méně než 18 let se závažnou ložiskovou psoriázou. Druhá studie (pediatrická studie 2) je otevřená studie s 84 pacienty ve věku od 6 do méně než 18 let se středně těžkou až těžkou ložiskovou psoriázou. Bezpečnostní profil hlášený v těchto dvou studiích byl v souladu s bezpečnostním profilem hlášeným u dospělých pacientů s ložiskovou psoriázou.Nežádoucí účinky u pediatrických pacientů s JIA
Bezpečnost sekukinumabu byla rovněž hodnocena ve studii fáze III u 86 pacientů s ERA a JPsA ve věku od 2 do méně než 18 let. Bezpečnostní profil hlášený v této studii byl v souladu s bezpečnostním profilem hlášeným u dospělých pacientů.
-
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky přímo na níže uvedenou adresu.
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
-
-
4.9 Předávkování
Dávky až do 30 mg/kg (přibližně 2 000 až 3 000 mg) byly v klinických studiích podány intravenózně bez známek na dávce závislé toxicity. V případě předávkování se doporučuje monitorovat pacienta s ohledem na známky nebo příznaky nežádoucích účinků a je potřeba neprodleně zahájit vhodnou symptomatickou léčbu.
5. FARMAKOLOGICKÉ VLASTNOSTI
-
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunosupresiva, inhibitory interleukinu, ATC kód: L04AC10
-
Mechanismus účinku
Sekukinumab je plně humánní IgG1/κ monoklonální protilátka, která se selektivně váže na prozánětlivý cytokin interleukin‑17A (IL‑17A) a neutralizuje ho. Sekukinumab působí zacílením na IL‑17A a inhibicí jeho interakce s receptorem pro IL‑17, který je exprimován různými typy buněk, včetně keratinocytů. Jako výsledek sekukinumab inhibuje uvolňování prozánětlivých cytokinů, chemokinů a mediátorů tkáňového poškození a snižuje IL‑17A‑zprostředkovaný příspěvek k autoimunitním a zánětlivým chorobám. V pokožce jsou dosaženy klinicky relevantní hladiny sekukinumabu a jsou redukovány lokální zánětlivé markery. Jako přímý důsledek léčby sekukinumabem dochází k redukci erytému, ztvrdnutí a odlupování pokožky přítomných v ložiskových psoriatických lézích.
IL‑17A je přirozeně se vyskytující cytokin, který se účastní normální zánětlivé a imunitní odpovědi. IL‑17A hraje klíčovou roli v patogenezi ložiskové psoriázy, hidradenitidy, psoriatické artritidy a axiální spondylartritidy (ankylozující spondylitida a non-radiografická axiální spondylartritida) a jeho množství je zvýšeno v kožních lézích v porovnání s pokožkou bez kožních lézí u pacientů s ložiskovou psoriázou a v synoviální tekutině pacientů s psoriatickou artritidou. Množství IL‑17A je rovněž zvýšeno v lézích při hidradenitidě a u postižených pacientů byly pozorovány zvýšené sérové hladiny IL‑17A. Četnost výskytu IL‑17 produkujících buněk byla též významně vyšší v subchondrální kostní dřeni intervertebrálních kloubů u pacientů s ankylozující spondylitidou. U pacientů s non-radiografickou axiální spondylartritidou bylo rovněž nalezeno zvýšené množství lymfocytů produkujících IL‑17A. Inhibice IL‑17A se ukázala být účinnou při léčbě ankylozující spondylitidy, čímž byla stanovena klíčová role tohoto cytokinu u axiální spondylartritidy.
-
Farmakodynamické účinky
Sérové hladiny celkového IL‑17A (volný a IL‑17As navázaným sekukinumabem) u pacientů léčených sekukinumabem zpočátku rostou. To je následováno pomalým poklesem z důvodu snížené clearance IL‑17A s navázaným sekukinumabem, což naznačuje, že sekukinumab selektivně vychytává volný IL‑17A, který hraje klíčovou roli v patogenezi ložiskové psoriázy.
Ve studii se sekukinumabem došlo po jednom až dvou týdnech léčby k signifikantnímu snížení infiltrujících epidermálních neutrofilů a různých s neutrofily spojovaných markerů, které jsou u pacientů s ložiskovou psoriázou v kožních lézích zvýšeny.
Sekukinumab snižoval (během 1 až 2 týdnů léčby) hladiny C reaktivního proteinu, který je markerem zánětu.
-
Klinická účinnost a bezpečnost
Ložisková psoriáza dospělých
Bezpečnost a účinnost sekukinumabu byly hodnoceny ve čtyřech randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III u pacientů se středně závažnou až závažnou ložiskovou psoriázou, kteří byli kandidáty pro fototerapii nebo systémovou terapii [ERASURE, FIXTURE, FEATURE, JUNCTURE]. Účinnost a bezpečnost 150 mg a 300 mg sekukinumabu byla hodnocena buď proti placebu nebo proti etanerceptu. Navíc jedna studie hodnotila chronický léčebný režim v porovnání s „přeléčením podle potřeby“ [SCULPTURE].Z 2 403 pacientů, kteří byli zařazeni do placebem kontrolovaných studií bylo 79 % biologicky naivních, 45 % bylo nebiologických selhání a 8 % byla biologická selhání (6 % anti‑TNF selhání a 2 % anti‑p40 selhání). Přibližně 15 až 25 % pacientů ve studiích fáze III mělo při zahájení léčby psoriatickou artritidu (PsA).
Psoriatická studie 1 (ERASURE) hodnotila 738 pacientů. Pacienti randomizovaní na sekukinumab dostávali dávku 150 mg nebo 300 mg v týdnech 0, 1, 2, 3 a 4, následované stejnou dávkou každý měsíc. Psoriatická studie 2 (FIXTURE) hodnotila 1 306 pacientů. Pacienti randomizovaní na sekukinumab dostávali dávku 150 mg nebo 300 mg v týdnech 0, 1, 2, 3 a 4, následované stejnou dávkou každý měsíc. Pacienti randomizovaní na etanercept dostávali dávku 50 mg dvakrát týdně po dobu 12 týdnů, následované dávkou 50 mg každý týden. V obou studiích 1 a 2 byli pacienti randomizovaní na placebo a neodpovídající na léčbu v týdnu 12 převedeni na sekukinumab (buď 150 mg nebo 300 mg) v týdnech 12, 13, 14, a 15, následované stejnou dávkou každý měsíc počínaje týdnem 16. Všichni pacienti byli sledováni po dobu až 52 týdnů od prvního podání medikace ve studii.
Psoriatická studie 3 (FEATURE) hodnotila 177 pacientů používajících předplněné injekční stříkačky v porovnání s placebem po 12 týdnech léčby pro zhodnocení bezpečnosti, tolerability a použitelnosti samoaplikace sekukinumabu pomocí předplněné injekční stříkačky. Psoriatická studie 4 (JUNCTURE) hodnotila 182 pacientů používajících předplněné pero v porovnání s placebem po 12 týdnech léčby pro zhodnocení bezpečnosti, snášenlivosti a použitelnosti samoaplikace sekukinumab pomocí předplněného pera. V obou studiích 3 a 4 pacienti randomizovaní na sekukinumab dostávali dávku 150 mg nebo 300 mg v týdnech 0, 1, 2, 3 a 4, následované stejnou dávkou každý měsíc. Pacienti byli též randomizováni na placebo v týdnech 0, 1, 2, 3 a 4, následované stejnou dávkou každý měsíc.
Psoriatická studie 5 (SCULPTURE) hodnotila 966 pacientů. Všichni pacienti dostávali sekukinumab v dávce 150 mg nebo 300 mg v týdnech 0, 1, 2, 3, 4, 8 a 12 a poté byli randomizováni buď k udržovací léčbě stejnou dávkou každý měsíc počínaje týdnem 12, nebo na režim s „přeléčením v čas potřeby“ stejnou dávkou. U pacientů randomizovaných k „přeléčení v čas potřeby“ nebylo dosaženo odpovídající udržení odpovědi a proto se doporučuje fixní měsíční udržovací režim.
Ko-primární cíl placebem a aktivním komparátorem kontrolovaných studií činil podíl pacientů s dosaženou odpovědí PASI 75 a IGA mód 2011 odpovědi “čistý” nebo “téměř čistý” v porovnání s placebem v týdnu 12 (viz tabulky 4 a 5). Dávka 300 mg poskytovala zlepšenou clearance pokožky zejména pro “čistou” nebo “téměř čistou” pokožku v rozmezí cílů účinnosti PASI 90, PASI 100, a IGA mód 2011 0 nebo 1 odpověď u všech studií s největším účinkem pozorovaným v týdnu 16, proto se doporučuje tato dávka.
Tabulka 4 Souhrnná PASI 50/75/90/100 & IGA* mód 2011 “čistá” nebo “téměř čistá” klinická odpověď v psoriatických studiích 1, 3 a 4 (ERASURE, FEATURE a JUNCTURE)
Týden 12
Týden 16
Týden 52
Placebo
150 mg
300 mg
150 mg
300 mg
150 mg
300 mg
Studie 1
Počet pacientů
246
244
245
244
245
244
245
Odpověď PASI 50 n (%)
22 (8,9 %)
203 (83,5 %)
222 (90,6 %)
212 (87,2 %)
224 (91,4 %)
187 (77 %)
207 (84,5 %)
Odpověď PASI 75 n (%)
11 (4,5 %)
174 (71,6 %)**
200 (81,6 %)**
188 (77,4 %)
211 (86,1 %)
146 (60,1 %)
182 (74,3 %)
Odpověď PASI 90 n (%)
3 (1,2 %)
95 (39,1 %)**
145 (59,2 %)**
130 (53,5 %)
171 (69,8 %)
88 (36,2 %)
147 (60,0 %)
Odpověď PASI 100 Odpověď n (%)
2 (0,8 %)
31 (12,8 %)
70 (28,6 %)
51 (21,0 %)
102 (41,6 %)
49 (20,2 %)
96 (39,2 %)
Odpověď IGA mód 2011 “čistý” nebo “téměř čistý” n (%)
6 (2,40 %)
125 (51,2 %)**
160 (65,3 %)**
142 (58,2 %)
180 (73,5 %)
101 (41,4 %)
148 (60,4 %)
Studie 3
Počet pacientů
59
59
58
‑
‑
‑
‑
Odpověď PASI 50 n (%)
3 (5,1 %)
51 (86,4 %)
51 (87,9 %)
‑
‑
‑
‑
Odpověď PASI 75 n (%)
0 (0,0 %)
41 (69,5 %)**
44 (75,9 %)**
‑
‑
‑
‑
Odpověď PASI 90 n (%)
0 (0,0 %)
27 (45,8 %)
35 (60,3 %)
‑
‑
‑
‑
Odpověď PASI 100 n (%)
0 (0,0 %)
5
(8,5 %)25 (43,1 %)
‑
‑
‑
‑
Odpověď IGA mód 2011 “čistý” nebo “téměř čistý” n (%)
0 (0,0 %)
31 (52,5 %)**
40 (69,0 %)**
‑
‑
‑
‑
Studie 4
Počet pacientů
61
60
60
‑
‑
‑
‑
Odpověď PASI 50 n (%)
5 (8,2 %)
48 (80,0 %)
58 (96,7 %)
‑
‑
‑
‑
Odpověď PASI 75 n (%)
2 (3,3 %)
43 (71,7 %)**
52 (86,7 %)**
‑
‑
‑
‑
Odpověď PASI 90 n (%)
0 (0,0 %)
24 (40,0 %)
33 (55,0 %)
‑
‑
‑
‑
Odpověď PASI 100 n (%)
0 (0,0 %)
10 (16,7 %)
16 (26,7 %)
‑
‑
‑
‑
Odpověď IGA mód 2011 “čistý” nebo “téměř čistý” n (%)
0 (0,0 %)
32 (53,3 %)**
44 (73,3 %)**
‑
‑
‑
‑
* IGA mód 2011 je 5 bodová škála zahrnující “0 = čistý”, “1 = téměř čistý”, “2 = mírný”, “3 = středně závažný” nebo “4 = závažný”, indikující lékařovo celkové hodnocení závažnosti psoriázy zaměřené na ztvrdnutí, erytém a odlupování. Léčebný úspěch “ čistý ” nebo “ téměř čistý ” znamenaly nepřítomnost známek psoriázy nebo normální až růžové zbarvené léze, netloustnutí ložisek a žádné nebo minimální místní odlupování.
** p-hodnoty versus placebo a nastavené na multiplicitu: p<0,0001.
Tabulka 5 Souhrn klinické odpovědi v psoriatické studii 2 (FIXTURE)
Týden 12
Týden 16
Týden 52
Placebo
150 mg
300 mg
Etanercept
150 mg
300 mg
Etanercept
150 mg
300 mg
Etanercept
Počet pacientů
324
327
323
323
327
323
323
327
323
323
Odpověď PASI 50 n (%)
49 (15,1 %)
266 (81,3 %)
296 (91,6 %)
226 (70,0 %)
290 (88,7 %)
302 (93,5 %)
257 (79,6 %)
249 (76,1 %)
274 (84,8 %)
234 (72,4 %)
Odpověď PASI 75 n (%)
16 (4,9 %)
219 (67,0 %)**
249 (77,1 %)**
142 (44,0 %)
247 (75,5 %)
280 (86,7 %)
189 (58,5 %)
215 (65,7 %)
254 (78,6 %)
179 (55,4 %)
Odpověď PASI 90 n (%)
5 (1,5 %)
137 (41,9 %)
175 (54,2 %)
67 (20,7 %)
176 (53,8 %)
234 (72,4 %)
101 (31,3 %)
147 (45,0 %)
210 (65,0 %)
108 (33,4 %)
Odpověď PASI 100 n (%)
0 (0 %)
47 (14,4 %)
78 (24,1 %)
14 (4,3 %)
84 (25,7 %)
119 (36,8 %)
24 (7,4 %)
65 (19,9 %)
117 (36,2 %)
32 (9,9 %)
Odpověď IGA mód 2011 “čistý” nebo “téměř čistý” n (%)
9 (2,8 %)
167 (51,1 %)**
202 (62,5 %)**
88 (27,2 %)
200 (61,2 %)
244 (75,5 %)
127 (39,3 %)
168 (51,4 %)
219 (67,8 %)
120 (37,2 %)
** p-hodnoty versus etanercept: p=0,0250
V další psoriatické studii (CLEAR) bylo hodnoceno 676 pacientů. V této studii byla s ohledem na primární a sekundární cílové parametry prokázána superiorita sekukinumabu v dávce 300 mg oproti ustekinumabu v odpovědích PASI 90 v 16. týdnu (primární cílový parametr), v rychlosti nástupu odpovědi PASI 75 ve 4. týdnu a v dlouhodobé odpovědi PASI 90 v 52. týdnu. Vyšší účinnost sekukinumabu v porovnání s ustekinumabem pro cílové parametry PASI 75/90/100 a odpověď IGA mod 2011 0 nebo 1 („čistý“ nebo „téměř čistý“) byla pozorována po celou dobu, od začátku do 52. týdne (tabulka 6).
Tabulka 6 Souhrn klinické odpovědi ve studii CLEAR
Týden 4
Týden 16
Týden 52
Sekukinumab 300 mg
Ustekinumab*
Sekukinumab 300 mg
Ustekinumab*
Sekukinumab 300 mg
Ustekinumab*
Počet pacientů
334
335
334
335
334
335
Odpověď PASI 75 n (%)
166 (49,7 %)**
69 (20,6 %)
311 (93,1 %)
276 (82,4 %)
306 (91,6 %)
262 (78,2 %)
Odpověď PASI 90 n (%)
70 (21,0 %)
18 (5,4 %)
264 (79,0 %)**
192 (57,3 %)
250 (74,9 %)***
203 (60,6 %)
Odpověď PASI 100 n (%)
14 (4,2 %)
3 (0,9 %)
148 (44,3 %)
95 (28,4 %)
150 (44,9 %)
123 (36,7 %)
Odpověď IGA mód 2011 „čistý“ nebo „téměř čistý“ n (%)
128 (38,3 %)
41 (12,2 %)
278 (83,2 %)
226 (67,5 %)
261 (78,1 %)
213 (63,6 %)
* Pacienti léčení sekukinumabem dostávali dávku 300 mg v týdnech 0, 1, 2, 3 a 4 následovanou stejnou dávkou vždy po 4 týdnech do 52. týdne. Pacienti léčení ustekinumabem dostávali dávku 45 mg nebo 90 mg v týdnech 0 a 4, a poté vždy po 12 týdnech do 52. týdne (dávka podle hmotnosti a schváleného dávkování)
** p-hodnoty versus ustekinumab: p<0,0001 pro primární cílový parametr PASI90 v 16. týdnu a sekundární cílový parametr PASI75 ve 4. týdnu
*** p-hodnoty versus ustekinumab: p<0,0001 pro sekundární cílový parametr PASI90 v 52. týdnuSekukinumab byl účinný u pacientů bez předchozí systémové léčby, biologicky naivních, biologicky/anti‑TNF‑exponovaných a pacientů s biologickým/anti‑TNF selháním. Zlepšení PASI 75 u pacientů se souběžnou psoriatickou artritidou při zahájení léčby byly podobné těm u celé populace s ložiskovou psoriázou.
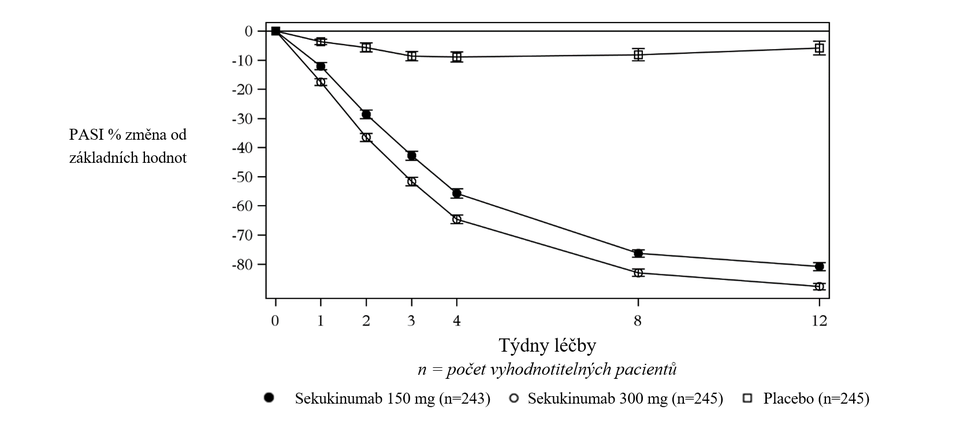
Sekukinumab byl spojován s rychlým nástupem účinku s 50% redukcí průměrného PASI do týdne 3 při dávce 300 mg.
Obrázek 1 Časový průběh procentní změny od výchozích hodnot průměrného PASI skóre ve studii 1 (ERASURE)
Specifické lokalizace/formy ložiskové psoriázy
Ve dvou dalších placebem kontrolovaných studiích bylo pozorováno zlepšení jak u nehtové psoriázy (studie TRANSFIGURE, 198 pacientů), tak u palmoplantární ložiskové psoriázy (studie GESTURE, 205 pacientů). Ve studii TRANSFIGURE byla prokázána superiorita sekukinumabu oproti placebu v 16. týdnu (46,1 % pro 300 mg, 38,4 % pro 150 mg a 11,7 % pro placebo) ve výrazném zlepšení oproti počátečnímu stavu podle indexu závažnosti psoriázy nehtů (NAPSI %) u pacientů se středně těžkou až těžkou ložiskovou psoriázou s postižením nehtů. Ve studii GESTURE byla prokázána superiorita sekukinumabu oproti placebu v 16. týdnu (33,3 % pro 300 mg, 22,1 % pro 150 mg a 1,5 % pro placebo) ve výrazném zlepšení oproti počátečnímu stavu podle odpovědi ppIGA 0 nebo 1 („čistý“ nebo „téměř čistý“) u pacientů se středně těžkou až těžkou palmoplantární ložiskovou psoriázou.V placebem kontrolované studii bylo hodnoceno 102 pacientů se středně těžkou až těžkou psoriázou ve vlasové části hlavy, definovanou hodnotou Psoriasis Scalp Severity Index (PSSI) ≥12, odpovědí dle skóre IGA, mod 2011, pouze ve vlasové části hlavy skóre 3 nebo větší a postižením nejméně 30 % plochy vlasové části. Ve 12. týdnu byla prokázána superiorita sekukinumabu 300 mg v porovnání s placebem ve výrazném zlepšení oproti počátečnímu stavu jak pro odpovědi PSSI 90 (52,9 % versus 2,0 %), tak u odpovědí dle skóre IGA, mod 2011, 0 nebo 1 pouze ve vlasové části hlavy (56,9 % versus 5,9 %). U pacientů pokračujících v léčbě sekukinumabem do 24. týdne bylo zlepšení hodnocené dle obou cílových parametrů setrvalé.
Kvalita života/výsledky hlášené pacienty
Statisticky zlepšení hodnot v týdnu 12 (studie 1‑4) oproti hodnotám před léčbou v porovnání s placebem bylo demonstrováno pomocí DLQI (Dermatology Life Quality Index). Průměrný pokles (zlepšení) DLQI z hodnot před léčbou kolísalo od ‑10,4 do ‑11,6 u sekukinumabu 300 mg, od ‑7,7 do ‑10,1 u sekukinumabu 150 mg, v porovnání s ‑1,1 až ‑1,9 u placeba v týdnu 12. Toto zlepšení přetrvávalo 52 týdnů (studie 1 a 2).Čtyřicet procent účastníků ve studiích 1 a 2 vyplnilo deník Psoriasis Symptom Diary©. U účastníků, kteří vyplnili tento deník, bylo v každé z těchto studií v porovnání s placebem prokázáno statisticky významné zlepšení z hodnot před léčbou v týdnu 12 u pacienty hlášených známek a příznaků svědění, bolesti a odlupování.
U pacientů léčených sekukinumabem, v porovnání s pacienty léčenými ustekinumabem (CLEAR), bylo ve 4. týdnu dle hodnoty DLQI prokázáno statisticky významné zlepšení oproti výchozímu stavu. Toto zlepšení přetrvávalo až do 52. týdne.
Záznamy v deníku Psoriasis Symptom Diary© doložily v 16. a 52. týdnu u pacientů léčených sekukinumabem, v porovnání s pacienty léčenými ustekinumabem, statisticky významné zlepšení v hodnocení pacienty hlášených známek a příznaků svědění, bolesti a odlupování (CLEAR).
Ve studii s pacienty s psoriázou ve vlasové části hlavy bylo ve 12. týdnu, v porovnání s placebem, prokázáno statisticky významné zlepšení oproti výchozímu stavu (pokles) v hodnocení známek a příznaků svědění, bolesti a odlupování hlášených pacienty.
Flexibilita dávky u ložiskové psoriázy
Randomizovaná, dvojitě zaslepená, multicentrická studie hodnotila dva udržovací dávkovací režimy (300 mg každé 2 týdny a 300 mg každé 4 týdny), dávky byly podávané 150 mg předplněnou injekční stříkačkou u 331 pacientů vážících ≥90 kg se středně těžkou až těžkou psoriázou.
Pacienti byli randomizováni v poměru 1:1 následovně:- sekukinumab 300 mg v týdnech 0, 1, 2, 3 a 4 následovaný stejnou dávkou každé 2 týdny
až do týdne 52 (n=165). - sekukinumab 300 mg v týdnech 0, 1, 2, 3 a 4 následovaný stejnou dávkou každé 4 týdny
až do týdne 16 (n=166).
-
- Pacienti randomizovaní k léčbě sekukinumabem 300 mg každé 4 týdny, kteří v týdnu 16 reagovali odpovědí PASI 90, pokračovali v podávání stejného dávkovacího režimu až do týdne 52.
Pacienti randomizovaní k léčbě sekukinumabem 300 mg každé 4 týdny, kteří v týdnu 16 nedosáhli odpovědi PASI 90, buď pokračovali v stejném dávkovacím režimu nebo byli přeřazeni na léčbu sekukinumabem 300 mg každé 2 týdny až do týdne 52.
- Pacienti randomizovaní k léčbě sekukinumabem 300 mg každé 4 týdny, kteří v týdnu 16 reagovali odpovědí PASI 90, pokračovali v podávání stejného dávkovacího režimu až do týdne 52.
Celkově byla míra odpovědi na léčbu vyšší u skupiny léčené v režimu každé 2 týdny v porovnání se
skupinou léčenou v režimu každé 4 týdny (tabulka 7).Tabulka 7 Shrnutí klinické odpovědi ve studii s flexibilitou dávky u ložiskové psoriázy*
Týden 16
Týden 52
sekukinumab
300 mg Q2Wsekukinumab
300 mg Q4Wsekukinumab
300 mg Q2Wsekukinumab
300 mg Q4W1Počet pacientů
165
166
165
83
Odpověď PASI 90 n (%)
121 (73,2%) **
92 (55,5%)
126 (76,4%)
44 (52,4%)
IGA mód 2011 “čistý” nebo “téměř čistý” n (%)
122 (74,2%)2
109 (65,9%)2
125 (75,9%)
46 (55,6%)
* Mnohočetné imputace
1 300 mg Q4W: pacienti kontinuálně léčení 300 mg Q4W bez ohledu na stav odpovědi PASI 90 v 16. týdnu;
43 pacientů bylo PASI 90 respondérů v týdnu 16 a 40 pacientů bylo PASI 90 non-respondérů v týdnu 16
** Jednostranná hodnota p = 0,0003 pro primární cílový parametr PASI 90 v týdnu 16
2 Hodnota není statisticky významná
Q2W: každé 2 týdny; Q4W: každé 4 týdnyU pacientů, kteří nereagovali odpovědí PASI 90 v 16. týdnu, u kterých byla dávka titrována na sekukinumab 300 mg každé 2 týdny, se míra odpovědi PASI 90 zlepšila v porovnání s těmi, kteří zůstali na dávkovacím režimu sekukinumab 300 mg každé 4 týdny, zatímco míra odpovědí IGA mód 2011 0/1 zůstala v průběhu času stabilní u obou léčebných skupin.
Bezpečnostní profily dvou dávkovacích režimů, Cosentyx 300 mg podávaný každé 4 týdny a Cosentyx 300 mg podávaný každé 2 týdny, u pacientů s hmotností ≥90 kg byly srovnatelné a konzistentní s bezpečnostním profilem hlášeným u pacientů s psoriázou.
Hidradenitida
Bezpečnost a účinnost sekukinumabu byly hodnoceny u 1 084 pacientů ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III u dospělých pacientů se středně těžkou až těžkou hidradenitidou (HS), kteří byli kandidáti pro systémovou biologickou léčbu. Na počátku léčby měli pacienti nejméně pět zánětlivých lézí postihujících alespoň dvě anatomické oblasti. V HS studii 1 (SUNSHINE) bylo I. stupněm klasifikováno 4,6 % pacientů , II. stupněm 61,4 % pacientů a III. stupněm Hurleyho skóre 34 % pacientů. V HS studii 2 (SUNRISE) bylo I. stupněm klasifikováno 2,8 % pacientů , II. stupněm 56,7 % pacientů a III. stupněm Hurleyho skóre 40,5 % pacientů. Poměr pacientů s hmotností ≥90 kg byl 54,7 % v HS studii 1 a 50,8 % v HS studii 2. Pacientům v těchto studiích byla průměrně před 7,3 lety diagnostikována středně těžká až těžká HS a 56,3 % účastníků studie byly ženy.
V HS studii 1 bylo 23,8 % pacientů v minulosti léčeno biologickou léčbou a celkem 82,3 % pacientů bylo v minulosti léčeno systémovými antibiotiky. V HS studii 2 bylo 23,2 % pacientů v minulosti léčeno biologickou léčbou a celkem 83,6 % pacientů bylo v minulosti léčeno systémovými antibiotiky.
V HS studii 1 bylo hodnoceno 541 pacientů, v HS studii 2 bylo hodnoceno 543 pacientů, z nichž 12,8 % resp. 10,7 % souběžně užívalo stálou dávku antibiotik. V obou studiích byli pacienti randomizováni na 300 mg sekukinumabu subkutánně v týdnech 0, 1, 2, 3 a 4 a dále 300 mg každé 2 týdny nebo každé 4 týdny. Pacienti, kteří byli randomizováni na placebo, byli v 16. týdnu převedeni na sekukinumab 300 mg v týdnech 16, 17, 18, 19 a 20 a dále sekukinumab 300 mg každé 2 týdny nebo sekukinumab 300 mg každé 4 týdny.
Primární cílový parametr v obou studiích (HS studii 1 a HS studii 2) byl poměr pacientů, kteří v 16. týdnu dosáhli klinické odpovědi definované jako alespoň 50% snížení počtu abscesů a zánětlivých nodulů bez zvýšení množství abscesů a/nebo množství drénujících fistul vzhledem k výchozí hodnotě (HiSCR50). Snížení bolesti kůže související s HS bylo hodnoceno jako sekundární cílový parametr na základě souhrnných údajů z HS studie 1 a HS studie 2 získaných pomocí číselné hodnoticí škály (NRS, Numerical Rating Scale) od pacientů, kteří vstoupili do studie s počátečním skóre 3 nebo vyšším.
V HS studii 1 a HS studii 2 dosáhl v 16. týdnu vyšší podíl pacientů léčených sekukinumabem 300 mg každé 2 týdny odpovědi HiSCR50 s poklesem počtu abscesů a zánětlivých nodulů (AN) ve srovnání s placebem. V HS studii 2 byl rovněž pozorován rozdíl v odpovědi HiSCR a počtu AN ve skupině se sekukinumabem 300 mg každé 4 týdny. Ve skupině se sekukinumabem 300 mg každé 2 týdny v HS studii 1 a ve skupině se sekukinumabem 300 mg každé 4 týdny v HS studii 2 došlo ve srovnání s placebem ke vzplanutí onemocnění do 16. týdne s nižší četností. Vyšší poměr pacientů léčených sekukinumabem 300 mg každé 2 týdny (souhrnné údaje) zaznamenal do 16. týdne klinicky významný pokles bolesti kůže související s HS ve srovnání s placebem (tabulka 8).
Tabulka 8 Klinická odpověď v HS studii 1 a HS studii 2 v 16. týdnu1
HS studie 1 HS studie 2 Placebo 300 mg Q4W 300 mg Q2W Placebo 300 mg Q4W 300 mg Q2W Počet randomizovaných pacientů 180 180 181 183 180 180 HiSCR50, n (%) 61
(33,7)75
(41,8)82
(45,0*)57
(31,2)83
(46,1*)76
(42,3*)Počet AN, průměrná změna oproti výchozí hodnotě, % ‑24,3 ‑42,4 ‑46,8* ‑22,4 ‑45,5* ‑39,3* Vzplanutí, n (%) 52
(29,0)42
(23,2)28
(15,4*)50
(27,0)28
(15,6*)36
(20,1)Souhrnné údaje (HS studie 1 a HS studie 2) Placebo 300 mg Q4W 300 mg Q2W Počet pacientů s výchozí hodnotou NRS ≥3 251 252 266 ≥30% redukce bolesti kůže, NRS30 odpověď, n (%) 58 (23,0) 84 (33,5) 97 (36,6*) 1 Ke zpracování chybějících údajů byla použita vícenásobná imputace
n: Zaokrouhlený průměr počtu subjektů s odpověďmi ve 100 imputacích
* Statisticky významné v porovnání s placebem na základě predefinované hierarchie s celkovou hodnotou ɑ=0,05
AN: abscesy a zánětlivé noduly; HiSCR: klinická odpověď hidradenitidy; NRS: číselná hodnoticí škála; Q4W: každé 4 týdny; Q2W: každé 2 týdnyV obou studiích se účinek sekukinumabu projevil již ve 2. týdnu, postupně rostl do 16. týdne a přetrval až do 52. týdne.
U primárního a nejdůležitějšího sekundárního cílového parametru bylo pozorováno zlepšení u pacientů s HS nezávisle na předchozí nebo souběžné antibiotické léčbě.
Zlepšení v parametru HiSCR50 bylo v 16. týdnu dosaženo jak u pacientů bez předchozí biologické léčby, tak u pacientů již vystavených biologické léčbě.
Výraznější zlepšení oproti výchozí hodnotě ve srovnání s placebem bylo prokázáno v 16. týdnu v kvalitě života související se zdravím podle dermatologického indexu kvality života (DLQI, Dermatology Life Quality Index).
Psoriatická artritida
Bezpečnost a účinnost sekukinumabu byla hodnocena u 1 999 pacientů ve třech randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III u pacientů s aktivní psoriatickou artritidou (≥3 oteklé a ≥3 bolestivé klouby) přes léčbu nesteroidními protizánětlivými léky (NSAID), kortikosteroidy nebo chorobu modifikujícími antirevmatiky (DMARD). Do těchto studií byli zařazeni pacienti všech subtypů PsA, včetně polyartikulární artritidy bez průkazu revmatoidních nodulů, spondylitidy s periferní artritidou, asymetrickou periferní artritidou, postižení distálních interfalangeálních kloubů a arthritis mutilans. Pacienti v těchto studiích měli stanovenu diagnózu PsA nejméně 5 let. Většina pacientů měla též aktivní psoriatické kožní léze nebo dokumentovanou psoriázu v anamnéze. Přes 61 % a 42 % pacientů s PsA mělo před zahájením entezitidu, respektive daktylitidu. Ve všech studiích bylo dosaženo primárního cíle – odpovědi ACR20 (American College of Rheumatology). V 1. studii s psoriatickou artritidou (PsA studie 1) a ve 2. studii s psoriatickou artritidou (PsA studie 2) byl primární cílový parametr ve 24. týdnu. Ve 3. studii s psoriatickou artritidou (PsA studie 3) byl primární cílový parametr v 16. týdnu s nejdůležitějším sekundárním cílovým parametrem, změnou od výchozích hodnot v modifikovaném mTSS (Total Sharp Score), který byl ve 24. týdnu.V PsA studii 1, PsA studii 2 a PsA studii 3 bylo 29 % pacientů, 35 % pacientů a 30 % pacientů, v uvedeném pořadí, již léčeno anti‑TNFα přípravkem a ukončilo užívání anti-TNFα přípravku buď pro nedostatek účinku nebo nesnášenlivost (anti-TNFα-IR pacienti).
PsA studie 1 (FUTURE 1) hodnotila 606 pacientů, z nichž 60,7 % užívalo současně MTX. Pacienti randomizovaní na sekukinumab dostávali dávku 10 mg/kg intravenózně v týdnech 0, 2 a 4, následovanou buď 75 mg nebo 150 mg subkutánně každý měsíc počínaje týdnem 8. Pacienti randomizovaní na placebo byli převedeni na sekukinumab (buď 75 mg nebo 150 mg subkutánně) s následnou stejnou dávkou každý měsíc, non-respondéři v 16. týdnu (časná záchrana) a ostatní ve 24. týdnu.
PsA studie 2 (FUTURE 2) hodnotila 397 pacientů, z nichž 46,6 % užívalo současně MTX. Pacienti randomizovaní na sekukinumab dostávali dávku 75 mg, 150 mg nebo 300 mg subkutánně v týdnech 0, 1, 2, 3 a 4, s následnou stejnou dávkou každý měsíc. Pacienti randomizovaní na placebo, kteří v týdnu 16 neodpovídali na léčbu byli v 16. týdnu (časná záchrana) převedeni na sekukinumab (buď 150 mg nebo 300 mg subkutánně) s následnou stejnou dávkou každý měsíc. Pacienti randomizovaní na placebo, kteří v 16. týdnu měli odpověď na léčbu, byli v 24. týdnu převedeni na sekukinumab (buď 150 mg nebo 300 mg subkutánně) s následnou stejnou dávkou každý měsíc.
PsA studie 3 (FUTURE 5) hodnotila 996 pacientů, z nichž 50,1 % užívalo současně MTX. Pacienti byli randomizováni do ramen se sekukinumabem 150 mg, 300 mg nebo placebo podávaných subkutánně v týdnech 0, 1, 2, 3 a 4, následovala stejná dávka každý měsíc nebo injekce obsahující 150 mg sekukinumabu aplikovaná jednou měsíčně (bez zaváděcích dávek). Pacienti randomizovaní do ramene s placebem, kteří neodpovídali na léčbu v týdnu 16 (časná záchrana) byli poté přeřazeni do ramene s podáváním sekukinumabu (buď 150 mg nebo 300 mg subkutánně) v týdnu 16, následovaným stejnou dávkou každý měsíc. Pacienti randomizovaní k užívání placeba, kteří odpovídali na léčbu v týdnu 16, byli přeřazeni do ramene s užíváním sekukinumabu (buď 150 mg nebo 300 mg subkutánně) v týdnu 24, následovaným stejnou dávkou každý měsíc.
Známky a příznaky
Léčba sekukinumabem v porovnání s placebem znamenala významné zlepšení v hodnocení aktivity choroby v týdnech 16 a 24 (viz tabulka 9).Tabulka 9 Klinická odpověď u PsA studie 2 a PsA studie 3 v týdnu 16 a v týdnu 24
PsA studie 2
PsA studie 3
Placebo
150 mg1
300 mg1
Placebo
150 mg1
300 mg1
Počet randomizovaných pacientů
98
100
100
332
220
222
ACR20 odpověď
n (%)týden 16
18
(18,4%)60
(60,0%***)57
(57,0%***)91◊
(27,4%)122◊
(55,5%***)139◊
(62,6%***)týden 24
15◊
(15,3%)51◊
(51,0%***)54◊
(54,0%***)78
(23,5%)117
(53,2%***)141
(63,5%***)ACR50 odpověď
n (%)týden 16
6
(6,1 %)37
(37,0%***)35
(35,0%***)27
(8,1%)79
(35,9%*)88
(39,6%*)týden 24
7
(7,1%)35
(35,0%)35
(35,0%**)29
(8,7%)86
(39,1%***)97
(43,7%***)ACR70 odpověď
n (%)týden 16
2
(2,0%)17
(17,0%**)15
(15,0%**)14
(4,2%)40
(18,2%***)45
(20,3%***)týden 24
1
(1,0%)21
(21,0%**)20
(20,0%**)13
(3,9%)53
(24,1%***)57
(25,7%***)DAS28‑CRP
týden 16
-0,50
-1,45***
-1,51***
-0,63
-1,29*
-1,49*
týden 24
-0,96
-1,58**
-1,61**
-0,84
-1,57***
-1,68***
Počet pacientů s ≥3% BSA psoriatickým postižením pokožky před zahájením léčby
43
(43,9%)58
(58,0%)41
(41,0%)162
(48,8%)125
(56,8%)110
(49,5%)PASI 75 odpověď
n (%)týden 16
3
(7,0%)33
(56,9%***)27
(65,9%***)20
(12,3%)75
(60,0%*)77
(70,0%*)týden 24
7
(16,3%)28
(48,3%**)26
(63,4%***)29
(17,9%)80
(64,0%***)78
(70,9%***)PASI 90 odpověď
n (%)týden 16
3
(7,0%)22
(37,9%***)18
(43,9%***)15
(9,3%)46
(36,8%*)59
(53,6%*)týden 24
4
(9,3%)19
(32,8%**)20
(48,8%***)19
(11,7%)51
(40,8%***)60
(54,5%***)Vymizení daktylitidy n (%) †
týden 16
10
(37%)21
(65,6%*)26
(56,5%)40
(32,3%)46
(57,5%*)54
(65,9%*)týden 24
4
(14,8%)16
(50,0%**)26
(56,5%**)42
(33,9%)51
(63,8%***)52
(63,4%***)Vymizení entezitidy n (%) ‡
týden 16
17
(26,2%)32
(50,0%**)32
(57,1%***)68
(35,4%)77
(54,6%*)78
(55,7%*)týden 24
14
(21,5%)27
(42,2%*)27
(48,2%**)66
(34,4%)77
(54,6%***)86
(61,4%***)* p<0,05, ** p<0,01, *** p<0,001; oproti placebu
Všechny p‑hodnoty jsou nastaveny na mnohočetné testování založené na předem definované hierarchii v týdnu 24 pro PsA studii 2, s výjimkou ACR70, daktylitidy a entezitidy, což byly exploratorní cíle a všechny cíle v týdnu 16.
Všechny p‑hodnoty jsou nastaveny na mnohočetné testování založené na předem definované hierarchii v týdnu 16 pro PsA studii 3, s výjimkou ACR70, což byl exploratorní cíl a všechny cíle v týdnu 24.
Pacienti s chybějícími údaji o léčebné odpovědi byli považováni za non-respondéry.
ACR: American College of Rheumatology; PASI: Psoriasis Area and Severity Index; DAS: Disease Activity Score (skóre aktivity nemoci); BSA: Body Surface Area (povrch těla)
◊Primary Endpoint (primární cíl)
11Sekukinumab 150 mg nebo 300 mg s.c. v týdnech 0, 1, 2, 3 a 4, následovaný stejnou dávkou každý měsíc
†U pacientů s daktylitidou při zahájení (n=27, 32, 46, v uvedeném pořadí pro PsA studii 2 a n=124, 80, 82, v uvedeném pořadí for PsA studii 3)
‡U pacientů s entezitidou při zahájení (n=65, 64, 56, v uvedeném pořadí pro PsA studii 2 a n=192, 141, 140, v uvedeném pořadí pro PsA studii 3)Nástup účinku sekukinumabu byl pozorován již ve 2. týdnu. Statisticky významného rozdílu v ACR20 oproti placebu bylo dosaženo ve 3. týdnu.
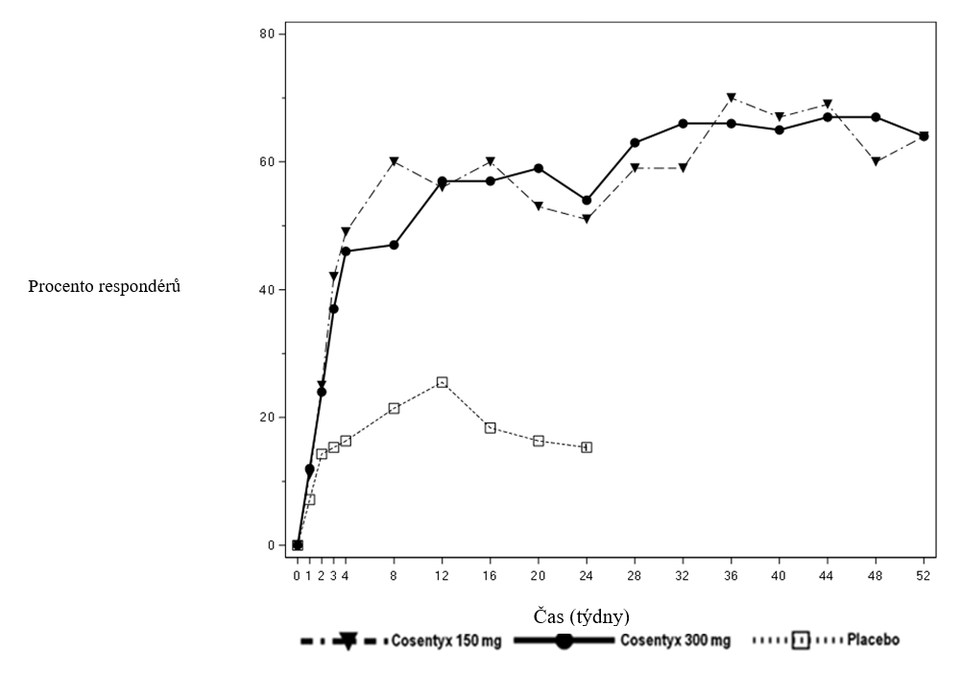
Procento pacientů s dosaženou ACR20 odpovědí je na obrázku 2.
Obrázek 2 ACR20 odpověď v PsA studii 2 v závislosti na čase do týdne 52
Podobné odpovědi pro primární a klíčový sekundární cílový parametr byly pozorovány u PsA pacientů bez ohledu na to, zda byli současně léčeni MTX či nikoliv. V PsA studii 2 v týdnu 24 měli pacienti léčení sekukinumabem a současně MTX vyšší ACR20 odpověď (47,7 % a 54,4 % u 150 mg a 300 mg, v porovnání s placebem 20,0 %) a ACR 50 odpověď (31,8 % a 38,6 % 150 mg a 300 mg v porovnání s placebem 8,0 %). Pacienti léčení sekukinumabem bez současně podávaného MTX měli vyšší ACR20 odpověď (53,6 % a 53,6 % u 150 mg a 300 mg, v porovnání s placebem 10,4 %) a ACR 50 odpověď (37,5 % a 32,1 % u 150 mg a 300 mg, v porovnání s placebem 6,3 %).
V PsA studii 2 měli jak anti-TNFα naivní, tak anti-TNFα-IR pacienti léčení sekukinumabem významně vyšší ACR20 odpověď v porovnání s placebem v týdnu 24, s mírně vyšší odpovědí u anti-TNFα naivní skupiny (anti-TNFα naivní: 64 % a 58 % u 150 mg a 300 mg, v porovnání s placebem 15,9 %; anti-TNFα-IR: 30 % a 46 % u 150 mg a 300 mg, v porovnání s placebem 14,3 %). V anti-TNFα-IR podskupině pacientů vykázala významně vyšší ACR20 odpověď v porovnání s placebem (p<0,05) pouze dávka 300 mg a demonstrovala klinicky smysluplný prospěch oproti 150 mg také ve více sekundárních cílech. Zlepšení PASI 75 odpovědi bylo pozorováno v obou podskupinách a dávka 300 mg prokázala statisticky signifikantní přínos u anti-TNFα-IR pacientů.
Zlepšení se objevilo u všech komponent ACR skóre, včetně hodnocení bolesti pacientem. Podíl pacientů s dosaženou modifikovanou PsA Response Criteria (PsARC) odpovědí v PsA studii 2 byl větší ve skupině pacientů léčených sekukinumabem (59,0 % a 61,0 % u 150 mg a 300 mg) v porovnání s placebem (26,5 %) v týdnu 24.
V PsA studii 1 a PsA studii 2 přetrvávala účinnost do týdne 104. V PsA studii 2 bylo v 52. týdnu stále léčeno 178 pacientů (89 %) z 200 pacientů iniciálně randomizovaných na sekukinumab 150 mg a 300 mg. Ze 100 pacientů randomizovaných na sekukinumab 150 mg, 64, respektive 39 a 20, vykázalo ACR20/50/70 odpověď. Ze 100 pacientů randomizovaných na sekukinumab 300 mg, 64, respektive 44 a 24 vykázalo ACR20/50/70 odpověď.
Radiografická odpověď
V PsA studii 3 byla inhibice progrese strukturálního poškození hodnocena radiograficky a vyjádřena pomocí modifikovaného mTSS (Total Sharp Score) a jeho komponent, ES (Erosion Score) a JSN (Joint Space Narrowing Score). Radiografické snímky rukou, zápěstí a nohou byly získány při zahájení léčby, v týdnu 16 a/nebo v týdnu 24 a zkontrolovány nezávisle alespoň dvěma hodnotiteli, kterým byly zaslepeny léčebné skupiny a pořadí návštěv. Léčba 150 mg a 300 mg sekukinumabu významně inhibovala míru progrese poškození periferních kloubů v porovnání s léčbou placebem, což bylo změřeno změnou od zahájení v mTSS v týdnu 24 (tabulka 10).Inhibice progrese strukturálního poškození byla také hodnocena v PsA studii 1 v týdnech 24 a 52, v porovnání s výchozími hodnotami. Data z týdne 24 jsou uvedena v tabulce 10.
Tabulka 10 Změna modifikovaného Total Sharp skóre u psoriatické artritidy
PsA studie 3
PsA studie 1
Placebo
n=296Sekukinumab 150 mg1
n=213Sekukinumab 300 mg1
n=217Placebo
n=179Sekukinumab 150 mg2
n=185Celkové skóre
Počáteční hodnoty
(SD)15,0
(38,2)13,5
(25,6)12,9
(23,8)28,4
(63,5)22,3
(48,0)Průměrná změna v týdnu 24
0,50
0,13*
0,02*
0,57
0,13*
*p<0,05 založená na nominální, ale neupravené p-hodnotě
1Sekukinumab 150 mg nebo 300 mg s.c. v týdnech 0, 1, 2, 3 a 4, následovaná stejnou dávkou každý měsíc
210 mg/kg v týdnech 0, 2 a 4, následovaná subkutánními dávkami 75 mg nebo 150 mgV PsA studii 1 přetrvávala inhibice strukturálního poškození při léčbě sekukinumabem do týdne 52.
V PsA studii 3 bylo procento pacientů bez progrese choroby (definované jako změna od výchozích hodnot v mTSS ≤0,5) od randomizace do 24. týdne 80,3 % u sekukinumabu 150 mg, 88,5 % u sekukinumabu 300 mg a 73,6 % u placeba. Účinek inhibice strukturálního poškození byl pozorován u anti-TNFα-naivních a anti-TNFα-IR pacientů a u pacientů léčených současně MTX a bez současného MTX.
V PsA studii 1 bylo procento pacientů bez progrese choroby (definované jako změna od výchozích hodnot mTSS ≤0,5) od randomizace do týdne 24 82,3 % ve větvi se sekukinumabem s dávkovacím schématem 10 mg/kg intravenózního bolusu – 150 mg subkutánně (udržovací dávka) a 75,7 % ve větvi s placebem. Procento pacientů bez progrese choroby od týdne 24 do týdne 52 u sekukinumabu 10 mg/kg ve formě intravenózního bolusu – následovaného 150 mg subkutánně (udržovací dávka) a u pacientů na placebu, kteří byli v týdnu 16 nebo 24 převedeni na 75 mg nebo 150 mg subkutánně (udržovací dávka) každé 4 týdny, bylo 85,7 % a 86,8 %.
Axiální postižení u PsA
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie (MAXIMISE) hodnotila účinnost sekukinumabu u 485 pacientů s PsA s axiálním postižením, kteří nebyli dosud léčeni biologickou léčbou a u nichž se nedostavila adekvátní odpověď na předchozí léčbu NSAID. Primární cíl, dosažení minimálně 20% zlepšení dle kritérií Assessment of SpondyloArthritis International Society (ASAS) ve 12. týdnu, byl splněn. Léčba sekukinumabem v dávce 300 mg a 150 mg, ve srovnání s placebem, vedla také k výraznějšímu zmírnění známek a symptomů onemocnění (včetně snížení bolesti páteře oproti výchozímu stavu) a zlepšení fyziologických funkcí (viz tabulka 11).Tabulka 11 Klinická odpověď ve studii MAXIMISE ve 12. týdnu
Placebo
(n=164)150 mg
(n=157)300 mg
(n=164)ASAS 20 odpověď, %
(95% CI)31,2 (24,6, 38,7) 66,3 (58,4, 73,3)* 62,9 (55,2, 70,0)* ASAS 40 odpověď, %
(95% CI)12,2 (7,8, 18,4) 39,5 (32,1, 47,4)** 43,6 (36,2, 51,3)** BASDAI 50, %
(95% CI)9,8 (5,9, 15,6) 32,7 (25,8, 40,5)** 37,4 (30,1, 45,4)** Bolest páteře, VAS
(95% CI)-13,6 (-17,2, -10,0) -28,5 (-32,2, -24,8)** -26,5 (-30,1, -22,9)** Fyziologické funkce, HAQ‑DI
(95% CI)-0,155 (-0,224, -0,086) -0,330 (-0,401,
-0,259)**-0,389 (-0,458,
-0,320)*** p<0,0001; oproti placebu použitím vícenásobné imputace.
** Srovnání s placebem nebylo upraveno pro mnohočetné testování.
ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; VAS: Visual Analog Scale; HAQ‑DI: Health Assessment Questionnaire – Disability Index.Zlepšení dle ASAS 20 a ASAS 40 pro obě dávky sekukinumabu bylo dosaženo ve 4. týdnu a bylo udržováno až 52 týdnů.
Funkční stav a kvalita života
V PsA studii 2 a PsA studii 3, pacienti léčení sekukinumabem 150 mg (p=0,0555 a p<0,0001) a 300 mg (p=0,0040 a p<0,0001) vykázali zlepšení funkčního stavu v porovnání s pacienty na placebu hodnocené podle Health Assessment Questionnaire‑Disability Index (HAQ‑DI) v týdnu 24 a 16, v uvedeném pořadí. Zlepšení HAQ‑DI skóre bylo pozorováno bez ohledu na předchozí expozici anti‑TNFα. Podobná odpověď byla pozorována v PsA studii 1.Pacienti léčení sekukinumabem hlásili významné zlepšení se zdravím související kvality života měřené pomocí Short Form-36 Health Survey Physical Component Summary (SF‑36 PCS) skóre (p<0,001). Prokázalo se též statisticky významé zlepšení, což bylo demonstrováno ve výzkumných cílech hodnocených Functional Assessment of Chronic Illness Therapy – Fatigue (FACIT-F) skóre u dávky 150 mg a 300 mg v porovnání s placebem (7,97, respektive 5,97 versus 1,63) a tato zlepšení byla zachována až do týdne 104 v PsA studii 2.
Podobné odpovědi byly pozorovány v PsA studii 1 a účinnost přetrvávala do týdne 52.
Axiální spondylartritida (axSpA
Ankylozující spondylitida (AS) / radiografická axiální spondylartritida
Bezpečnost a účinnost sekukinumabu byla hodnocena u 816 pacientů ve třech randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III u pacientů s aktivní ankylozující spondylitidou (AS) s Bath Ankylosing Spondylitis Disease Activity indexem (BASDAI) ≥4 přes léčbu nesteroidními protizánětlivými léky (NSAID), kortikosteroidy nebo chorobu modifikujícími antirevmatiky (DMARD). Pacienti ve studii ankylozující spondylitidy 1 (AS studie 1) a studii ankylozující spondylitidy 2 (AS studie 2) měli stanovenu diagnózu AS s mediánem 2,7 až 5,8 roku. V obou studiích bylo primárním cílem nejméně 20% zlepšení Assessment of SpondyloArthritis International Society kritéria (ASAS 20) v týdnu 16.Ve studii ankylozující spondylitidy 1 (AS studie 1), studii ankylozující spondylitidy 2 (AS studie 2) a studii ankylozující spondylitidy 3 (AS studie 3) 27,0 %, respektive 38,8 % a 23,5 % pacientů, bylo dříve léčeno anti-TNFα přípravkem a léčba anti-TNFα přípravkem byla ukončena buď pro nedostatek účinku nebo nesnášenlivost (anti-TNFα-IR pacienti).
AS Studie 1 (MEASURE 1) hodnotila 371 pacientů, z nichž užívalo současně 14,8 %, respektive 33,4 %, MTX nebo sulfasalazin. Pacienti randomizovaní na sekukinumab dostávali dávku 10 mg/kg intravenózně v týdnech 0, 2 a 4, následovanou buď 75 mg nebo 150 mg subkutánně každý měsíc počínaje týdnem 8. Pacienti randomizovaní na placebo byli převedeni na sekukinumab (buď 75 mg nebo 150 mg subkutánně) s následnou stejnou dávkou každý měsíc, non respondéři v 16. týdnu (časná záchrana) a všichni ostatní ve 24. týdnu.
AS studie 2 (MEASURE 2) hodnotila 219 pacientů, z nichž užívalo současně 11,9 %, respektive 14,2 %, MTX nebo sulfasalazin. Pacienti randomizovaní na sekukinumab dostávali dávku 75 mg nebo 150 mg subkutánně v týdnech 0, 1, 2, 3 a 4, s následnou stejnou dávkou každý měsíc. V týdnu 16 byli pacienti při zahájení randomizovaní na placebo re-randomizováni na sekukinumab (buď 75 mg nebo 150 mg subkutánně) každý měsíc.
AS Studie 3 (MEASURE 3) hodnotila 226 pacientů, z nichž užívalo současně 13,3 %, respektive 23,5 %, MTX nebo sulfasalazin. Pacienti randomizovaní na sekukinumab dostávali dávku 10 mg/kg intravenózně v týdnech 0, 2 a 4, následovanou subkutánním podáním buď 150mg nebo 300mg každý měsíc. V týdnu 16 byli pacienti při zahájení randomizovaní na placebo re-randomizováni na sekukinumab (buď 150 mg nebo 300 mg subkutánně) každý měsíc. Primárním cílem bylo ASAS 20 v týdnu 16. Pacienti byli zaslepeni co se týče léčebného režimu do týdne 52 a studie pokračovala do týdne 152.
Známky a příznaky:
V AS studii 2 znamenala léčba 150 mg sekukinumabu v porovnání s placebem větší zlepšení v hodnocení aktivity choroby v týdnu 16 (viz tabulka 12).Tabulka 12 Klinická odpověď v AS studii 2 v týdnu 16
Výsledek (p-hodnota versus placebo)
Placebo
(n = 74)75 mg
(n = 73)150 mg
(n = 72)ASAS 20 odpověď, %
28,4
41,1
61,1***
ASAS 40 20 odpověď, %
10,8
26,0
36,1***
hsCRP, (post‑BSL/BSL ratio)
1,13
0,61
0,55***
ASAS 5/6, %
8,1
34,2
43,1***
ASAS částečná remise, %
4,1
15,1
13,9
BASDAI 50, %
10,8
24,7*
30,6**
ASDAS-CRP velké zlepšení
4,1
15,1*
25,0***
* p<0,05, ** p<0,01, *** p<0,001; versus placebo
Všechny p-hodnoty jsou nastaveny na mnohočetné testování založené na předem definované hierarchii, s výjimkou BASDAI 50 a ASDAS-CRP
Pacienti s chybějícími údaji o léčebné odpovědi byli považováni za non-respondéry.ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: high‑sensitivity C‑reactive protein; ASDAS: Ankylosing Spondylitis Disease Activity Score; BSL: baseline
V AS studii 2 se nástup účinku 150 mg sekukinumabu projevil již v týdnu 1 (superiorita Cosentyxu vůči placebu u odpovědi ASAS 20) a v týdnu 2 (superiorita Cosentyxu vůči placebu u odpovědi ASAS 40).
ASAS 20 se zlepšila v týdnu 16 jak u anti‑TNFα-naivních pacientů (68,2 % versus 31,1 %; p<0,05), tak u anti‑TNFα‑IR pacientů (50,0 % versus 24,1 %; p<0,05) u 150 mg sekukinumabu v porovnání s placebem.
V AS studii 1 a AS studii 2 došlo u pacientů léčených sekukinumabem (150 mg v AS Studii 2 a oběma režimy AS studie 1) v 16. týdnu k významnému zlepšení známek a příznaků se srovnatelným rozsahem odpovědi. Účinnost přetrvávala do 52. týdne jak u anti-TNFα-naivních, tak u anti-TNFα-IR pacientů. V AS studii 2 bylo v 52. týdnu stále léčeno 61 pacientů (84,7 %) ze 72 pacientů iniciálně randomizovaných na 150 mg sekukinumabu. Ze 72 pacientů randomizovaných na 150 mg sekukinumabu, 45, respektive 35, vykázalo ASAS 20/40 odpověď.
V AS studii 3, došlo u pacientů léčených sekukinumabem (150 mg a 300 mg) ke zlepšení známek a příznaků a vykazovali, nezávisle na dávce, srovnatelnou odpověď na léčbu co se týká účinnosti, která byla superiorní vůči placebu v týdnu 16 pro primární cílový parametr (ASAS 20). Celkově byla míra odezvy účinnosti u skupiny 300 mg trvale vyšší ve srovnání se skupinou 150 mg pro sekundární cílové parametry. Během zaslepeného období byly odpovědi ASAS 20 a ASAS 40 69,7% a 47,6% pro 150 mg a 74,3% a 57,4% pro 300 mg v 52. týdnu. Reakce ASAS 20 a ASAS 40 přetrvávaly až do týdne 156 (69,5% a 47,6% pro 150 mg oproti 74,8% a 55,6% pro 300 mg). Vyšší míra odpovědi ve prospěch 300 mg byla také pozorována u odpovědi na ASAS parciální remise (ASAS PR) v 16. týdnu a přetrvávala až do týdne 156. U pacientů s anti-TNFα-IR (n=36) byly pozorovány větší rozdíly v míře odezvy, preferující dávku 300 mg nad 150 mg, ve srovnání s anti-TNFα-naivními pacienty (n=114).
Mobilita páteře
Pacienti léčení sekukinumabem v dávce 150 mg vykázali zlepšenou mobilitu páteře hodnocenou jako změnu BASMI v týdnu 16 v porovnání s hodnotami před léčbou v AS studii 1 (‑0,40 versus ‑0,12 pro placebo; p=0,0114) a v AS studii 2 (‑0,51 versus ‑0,22 pro placebo; p=0,0533). Tato zlepšení přetrvávala do týdne 52.Funkční stav a se zdravím související kvalita života
V AS studii 1 a studii 2, vykázali pacienti léčení 150 mg sekukinumabu zlepšení zdravotního stavu a kvality života, což bylo měřeno AS Quality of Life Dotazníkem (ASQoL) (p=0,001) a SF-36 Physical Component Summary (SF-36PCS) (p<0,001). Pacienti léčení 150 mg sekukinumabu také vykázali statisticky významné zlepšení ve fyzické funkci ve výzkumných cílech, což bylo zhodnoceno Bath Ankylosing Spondylitis Functional Indexem (BASFI) v porovnání s placebem (-2,15 versus -0,68), a v únavě, což bylo zhodnoceno Functional Assessment of Chronic Illness Therapy-Fatigue (FACIT-Fatigue) škálou v porovnání s placebem (8,10 versus 3,30). Tato zlepšení přetrvávala do týdne 52.Non-radiografická axiální spondylartritida (nr-axSpA)
Bezpečnost a účinnost sekukinumabu byla hodnocena u 555 pacientů v jedné randomizované dvojitě slepé placebem kontrolované studii fáze III (PREVENT), sestávající z 2leté základní fáze a 2leté prodloužené fáze, u pacientů s aktivní non-radiografickou axiální spondylartritidou (nr-axSpA) splňující klasifikační kritéria Assessment of SpondyloArthritis International Society (ASAS) pro axiální spondylartritidu (axSpA) bez radiografického průkazu změn v sakroiliakálních kloubech, které by splňovaly modifikovaná New York kritéria pro ankylozující spondylitidu (AS). Zařazení pacienti měli aktivní onemocnění, definované jako Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) ≥4, a hodnotu na vizuální analogové škále (VAS) pro celkovou bolest v zádech ≥40 (na stupnici 0-100 mm), navzdory současné nebo předchozí terapii nesteroidními protizánětlivými léčivy (NSAID) a zvýšený C-reaktivní protein (CRP) a/nebo známky sakroiliitidy při zobrazení magnetickou rezonancí (MRI). Pacienti v této studii měli diagnózu axSpA v průměru 2,1 až 3,0 roku a 54% účastníků studie byly ženy.Ve studii PREVENT bylo 9,7% pacientů léčeno nejdříve anti-TNFα přípravkem a anti-TNFα přípravek byl vysazen z důvodu nedostatečné účinnosti nebo nesnášenlivosti (anti-TNFα-IR pacienti).
Ve studii PREVENT užívalo 9,9% a 14,8% pacientů souběžně MTX nebo sulfasalazin. Ve dvojitě zaslepeném období pacienti dostávali buď placebo nebo sekukinumab po dobu 52 týdnů. Pacienti randomizovaní na sekukinumab používali 150 mg subkutánně v týdnech 0, 1, 2, 3 a 4, po nichž následovala stejná dávka každý měsíc, nebo jednou měsíčně injekce se 150 mg sekukinumabu. Primárním cílovým parametrem bylo alespoň 40% zlepšení kritéria Assessment of SpondyloArthritis International Society (ASAS 40) v 16. týdnu u anti-TNFα-naivních pacientů.
Příznaky a symptomy:
Ve studii PREVENT vedla léčba sekukinumabem 150 mg k významnému zlepšení míry aktivity choroby v porovnání s placebem v 16. týdnu. Tato míra aktivity zahrnuje ASAS 40, ASAS 5/6, skóre BASDAI, BASDAI 50, CRP s vysokou citlivostí (hsCRP), ASAS 20 a částečnou remisi ASAS v porovnání s placebem (tabulka 13). Odpověď přetrvávala až do 52. týdne.Tabulka 13 Klinická odpověď ve studii PREVENT v týdnu 16
Výsledek (p-hodnota versus placebo)
Placebo
150 mg1
Počet anti-TNFα-naivních randomizovaných pacientů
171
164
Odpověď ASAS 40, %
29,2
41,5*
Celkový počet randomizovaných pacientů
186
185
Odpověď ASAS 40, %
28,0
40,0*
ASAS 5/6, %
23,7
40,0*
BASDAI, LS průměrná změna od výchozí hodnoty skóre
-1,46
-2,35*
BASDAI 50, %
21,0
37,3*
hsCRP, (poměr post-BSL/BSL)
0,91
0,64*
Odpověď ASAS 20, %
45,7
56,8*
Částečná remise ASAS, %
7,0
21,6*
*p<0,05 versus placebo
Všechny p-hodnoty byly upraveny pro větší počet testů na základě předem definované hierarchie
Pro chybějící binární cíl byla použita imputace non-respondérů
1Sekukinumab 150 mg s.c. v týdnech 0, 1, 2, 3 a 4 následovaný stejnou dávkou každý měsícASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: C-reaktivní protein s vysokou citlivostí; BSL: výchozí hodnota; LS: Nejmenší čtverce
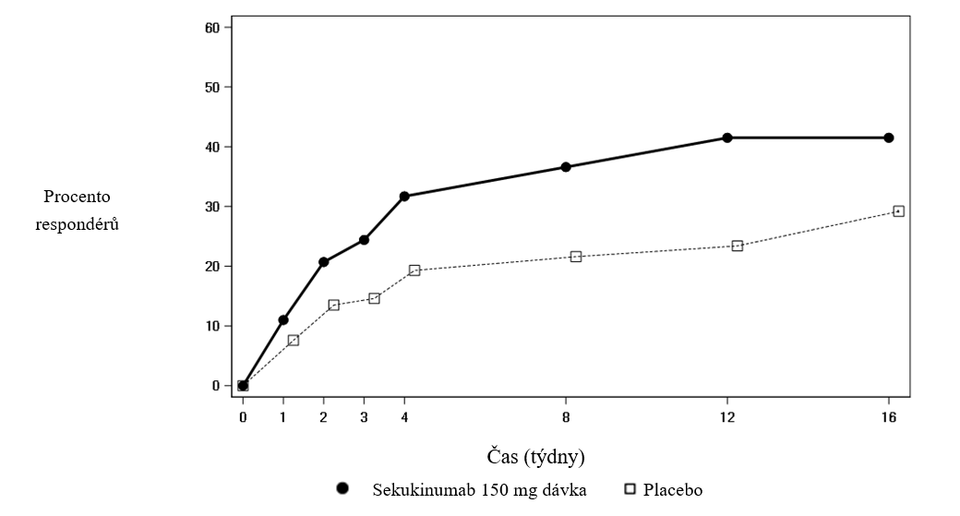
Nástup účinku sekukinumabu 150 mg ve studii PREVENT pro ASAS 40 u anti-TNFα-naivních pacientů (superiorní vůči placebu) se objevil již ve 3. týdnu. Procento ze všech anti-TNFα-naivních pacientů, kteří dosáhli odpovědi ASAS 40 v závislosti na čase je uvedeno na obrázku 3.
Obrázek 3 ASAS 40 odpovědi u anti-TNFα naivních pacientů ve studii PREVENT v průběhu času do 16. týdne
V 16. týdnu se u sekukinumabu 150 mg v porovnání s placebem objevilo u anti-TNFα-IR pacientů zlepšení ASAS 40 odpovědi.
Fyzické funkce a se zdravím související kvalita života:
Pacienti léčeni sekukinumabem 150 mg vykazovali statisticky významná zlepšení fyzické funkce do 16. týdne ve srovnání s pacienty léčenými placebem, hodnocené podle BASFI (týden 16: -1,75 versus -1,01, p<0,05). Pacienti léčeni sekukinumabem zaznamenali významné zlepšení ve srovnání s pacienty na placebu do 16. týdne v kvalitě života související se zdravím hodnocené podle ASQoL (průměrná změna LS: 16. týden: -3,45 versus -1,84, p<0,05) a SF-36 Physical Component Summary (SF-36 PCS) (LS průměrná změna: týden 16: 5,71 versus 2,93, p<0,05). Tato zlepšení přetrvávala až do 52. týdne.Spinální mobilita:
Spinální mobilita byla hodnocena podle BASMI až do 16. týdne. Numericky větší zlepšení byla prokázána u pacientů léčených sekukinumabem v porovnání s pacienty na placebu ve 4., 8., 12. a 16. týdnu.Inhibice zánětu při zobrazení magnetickou rezonancí (MRI):
Příznaky zánětu byly hodnoceny pomocí MRI na začátku a v 16. týdnu a byly vyjádřeny jako změna oproti základní hodnotě v Berlin SI-joint oedema skóre pro sakroiliakální klouby a ASspiMRI-a skóre a Berlin spine skóre pro páteř. U pacientů léčených sekukinumabem byla pozorována inhibice zánětlivých příznaků jak pro sakroiliakální klouby, tak i pro páteř. Průměrná změna oproti výchozím hodnotám v Berlin SI-joint oedema skóre byla -1,68 u pacientů léčených sekukinumabem 150 mg (n=180) oproti -0,39 u pacientů na placebu (n=174) (p<0,05). - sekukinumab 300 mg v týdnech 0, 1, 2, 3 a 4 následovaný stejnou dávkou každé 2 týdny
-
Pediatrická populace
Ložisková psoriáza u pediatrické populace
Bylo prokázáno, že sekukinumab zlepšuje známky a příznaky a kvalitu života u pediatrických pacientů s ložiskovou psoriázou ve věku 6 let a starších (viz tabulky 15 a 17).Těžká ložisková psoriáza
Bezpečnost a účinnost sekukinumabu byla hodnocena v randomizované, dvojitě zaslepené, placebem a etanerceptem kontrolované studii fáze III u dětských pacientů ve věku od 6 do <18 let s těžkou ložiskovou psoriázou, definovanou pomocí skóre PASI ≥20, IGA mod 2011 skóre 4 a poměru BSA ≥ 10 %, kteří byli kandidáty na systémovou terapii. Přibližně 43 % pacientů mělo předchozí expozici fototerapii, 53 % konvenční systémové terapii, 3 % biologické léčbě a 9 % mělo souběžnou psoriatickou artritidu.V pediatrické studii psoriázy 1 bylo hodnoceno 162 pacientů, kteří byli randomizováni k podávání nízké dávky sekukinumabu (75 mg pro tělesnou hmotnost <50 kg nebo 150 mg pro tělesnou hmotnost ≥50 kg), vysoké dávky sekukinumabu (75 mg pro tělesnou hmotnost <25 kg, 150 mg pro tělesnou hmotnost mezi >25 kg a <50 kg nebo 300 mg pro tělesnou hmotnost >50 kg), nebo placeba v týdnech 0, 1, 2, 3 a 4 následované stejnou dávkou každé 4 týdny, nebo etanerceptem. Pacienti randomizovaní na etanercept dostávali 0,8 mg/kg týdně (až do maxima 50 mg). Rozdělení pacientů podle hmotnosti a věku při randomizaci je popsáno v tabulce 14.
Tabulka 14 Rozdělení pacientů podle hmotnosti a věku v pediatrické studii psoriázy 1
Randomizační vrstvy Popis Sekukinumab
nízká dávka
n=40Sekukinumab
vysoká dávka
n=40Placebo
n=41Etanercept
n=41Celkem
N=162Věk 6-<12 let 8 9 10 10 37 ≥12-<18 let 32 31 31 31 125 Hmotnost <25 kg 2 3 3 4 12 ≥25-<50 kg 17 15 17 16 65 ≥50 kg 21 22 21 21 85 Pacienti randomizovaní na placebo a bez odpovědi na léčbu ve 12. týdnu byli přeřazeni do skupiny s nízkou nebo vysokou dávkou sekukinumabu (dávka podle skupiny tělesné hmotnosti) a dostávali studijní medikaci ve 12., 13., 14. a 15. týdnu, následovanou stejnými dávkami každé 4 týdny počínaje 16. týdnem. Ko-primárními cílovými parametry byly podíl pacientů, kteří dosáhli odpovědi PASI 75 a odpovědi IGA mod 2011 „čistá“ nebo „téměř čistá“ (0 nebo 1) ve 12. týdnu.
Během 12týdenního placebem kontrolovaného období byla účinnost jak nízké, tak vysoké dávky sekukinumabu srovnatelná pro ko-primární cílové parametry. Odhady poměru šancí ve prospěch obou dávek sekukinumabu byly statisticky významné pro odpovědi PASI 75 a IGA mod 2011 0 nebo 1.
Během 52 týdnů po první dávce byli všichni pacienti sledováni z hlediska účinnosti a bezpečnosti. Podíl pacientů, kteří dosáhli odpovědí PASI 75 a IGA mod 2011 „čistá“ nebo „téměř čistá“ (0 nebo 1) vykazoval rozdíl mezi skupinou léčenou sekukinumabem a placebem při první návštěvě po zahájení léčby ve 4. týdnu, přičemž rozdíl se stal výraznějším ve 12. týdnu. Odpověď přetrvávala po celou dobu 52 týdnů (viz tabulka 15). V průběhu 52týdenního časového období také přetrvávalo zlepšení v počtu odpovědí PASI 50, 90, 100 a Children’s Dermatology Life Quality Index (CDLQI) skóre 0 nebo 1.
Kromě toho byl počet odpovědi PASI 75, IGA 0 nebo 1, PASI 90 ve 12. a 52. týdnu ve skupinách se sekukinumabem s nízkou i vysokou dávkou vyšší než u pacientů léčených etanerceptem (viz tabulka 15).
Po 12. týdnu byla účinnost jak nízké, tak vysoké dávky sekukinumabu srovnatelná, i když účinnost vysoké dávky byla vyšší u pacientů ≥ 50 kg. Bezpečnostní profily nízké dávky a vysoké dávky byly srovnatelné a konzistentní s bezpečnostním profilem u dospělých.
Tabulka 15 Přehled klinické odpovědi u těžké pediatrické psoriázy v týdnech 12 a 52 (pediatrická studie psoriázy 1)*
Kritérium odpovědi Srovnání odpovědi 'test' 'kontrola' Odhad poměru šancí 'test' vs. 'kontrola' n**/m (%) n**/m (%) (95% CI) p-hodnota Týden 12*** PASI 75 sekukinumab nízká dávka vs. placebo 32/40 (80,0) 6/41 (14,6) 25,78 (7,08; 114,66) <0,0001 sekukinumab vysoká dávka vs. placebo 31/40 (77,5) 6/41 (14,6) 22,65 (6,31; 98,93) <0,0001 sekukinumab nízká dávka vs. etanercept 32/40 (80,0) 26/41 (63,4) 2,25 (0,73; 7,38) sekukinumab vysoká dávka vs. etanercept 31/40 (77,5) 26/41 (63,4) 1,92 (0,64; 6,07) IGA 0/1 sekukinumab nízká dávka vs. placebo 28/40 (70,0) 2/41 (4,9) 51,77 (10,02; 538,64) <0,0001 sekukinumab vysoká dávka vs. placebo 24/40 (60,0) 2/41 (4,9) 32,52 (6,48; 329,52) <0,0001 sekukinumab nízká dávka vs. etanercept 28/40 (70,0) 14/41 (34,1) 4,49 (1,60; 13,42) sekukinumab vysoká dávka vs. etanercept 24/40 (60,0) 14/41 (34,1) 2,86 (1,05; 8,13) PASI 90 sekukinumab nízká dávka vs. placebo 29/40 (72,5) 1/41 (2,4) 133,67 (16,83; 6395,22) <0,0001 sekukinumab vysoká dávka vs. placebo 27/40 (67,5) 1/41 (2,4) 102,86 (13,22; 4850,13) <0,0001 sekukinumab nízká dávka vs. etanercept 29/40 (72,5) 12/41 (29,3) 7,03 (2,34; 23,19) sekukinumab vysoká dávka vs. etanercept 27/40 (67,5) 12/41 (29,3) 5,32 (1,82; 16,75) Týden 52 PASI 75 sekukinumab nízká dávka vs. etanercept 35/40 (87.5) 28/41 (68,3) 3,12 (0,91; 12,52) sekukinumab vysoká dávka vs. etanercept 35/40 (87.5) 28/41 (68,3) 3,09 (0,90; 12,39) IGA 0/1 sekukinumab nízká dávka vs. etanercept 29/40 (72.5) 23/41 (56,1) 2,02 (0,73; 5,77) sekukinumab vysoká dávka vs. etanercept 30/40 (75.0) 23/41 (56,1) 2,26 (0,81; 6,62) PASI 90 sekukinumab nízká dávka vs. etanercept 30/40 (75.0) 21/41 (51,2) 2,85 (1,02; 8,38) sekukinumab vysoká dávka vs. etanercept 32/40 (80.0) 21/41 (51,2) 3,69 (1,27; 11,61) * u chybějících hodnot non-respondérů byla použita imputace
** n je počet responderů, m = počet vyhodnotitelných pacientů
*** rozšířené okno pro návštěvu v 12. týdnu
Poměr šancí, 95% interval spolehlivosti, a p-hodnota pochází z exaktního logistického regresního modelu s léčebnou skupinou, s kategoriemi tělesná hmotnost před léčbou a věk jako faktoryVyšší podíl pediatrických pacientů léčených sekukinumabem uváděl zlepšení se zdravím související kvality života, měřeno pomocí skóre CDLQI 0 nebo 1 v porovnání s placebem ve 12. týdnu (nízká dávka 44,7 %, vysoká dávka 50 %, placebo 15 %). Během celého průběhu do a včetně týdne 52 byly obě skupiny s dávkou sekukinumabu numericky větší než skupina s etanerceptem (nízká dávka 60,6 %, vysoká dávka 66,7 %, etanercept 44,4 %).
Středně těžká až těžká ložisková psoriáza
U sekukinumabu se předpokládala účinnost při léčbě pediatrických pacientů se středně těžkou ložiskovou psoriázou na základě prokázaného vztahu účinnosti a odpovědi na expozici u dospělých pacientů se středně těžkou až těžkou ložiskovou psoriázou a podobnosti průběhu onemocnění, patofyziologie a účinku léčiva u dospělých a pediatrických pacientů při stejných úrovních expozice.Kromě toho byla bezpečnost a účinnost sekukinumabu hodnocena v otevřené dvouramenné multicentrické studii fáze III s paralelní skupinou u dětských pacientů ve věku od 6 do <18 let se střední až těžkou ložiskovou psoriázou, definovanou skóre PASI ≥12, skóre IGA mod 2011 ≥3 a poměr BSA>10 %, kteří byli kandidáty na systémovou terapii.
V pediatrické studii psoriázy 2 bylo hodnoceno 84 pacientů, kteří byli randomizováni k podávání nízké dávky sekukinumabu (75 mg u tělesné hmotnosti <50 kg nebo 150 mg u tělesné hmotnosti ≥ 50 kg) nebo vysoké dávky sekukinumabu (75 mg pro tělesnou hmotnost <25 kg, 150 mg pro tělesnou hmotnost mezi >25 kg a <50 kg nebo 300 mg pro tělesnou hmotnost>50 kg) v týdnech 0, 1, 2, 3 a 4, následovaná stejnou dávkou každé 4 týdny. Rozdělení pacientů podle hmotnosti a věku při randomizaci je popsáno v tabulce 16.
Tabulka 16 Rozdělení pacientů podle hmotnosti a věku v pediatrické studii psoriázy 2
Podskupiny Popis Sekukinumab
Nízká dávka
n=42Sekukinumab
Vysoká dávka
n=42Celkem
N=84Věk 6-<12 let 17 16 33 ≥12-<18 let 25 26 51 Hmotnost <25 kg 4 4 8 ≥25-<50 kg 13 12 25 ≥50 kg 25 26 51 Ko-primárními cílovými parametry byly podíl pacientů, kteří dosáhli odpovědi PASI 75 a odpovědi IGA mod 2011 „čistá“ nebo „téměř čistá“ (0 nebo 1) ve 12. týdnu.
Účinnost nízké i vysoké dávky sekukinumabu byla srovnatelná a vykazovala statisticky významné zlepšení ve srovnání s anamnézou placeba pro ko-primární cílové parametry. Odhadovaná pozdější pravděpodobnost pozitivního léčebného účinku byla 100 %.
Účinnost byla u pacientů sledována po dobu 52 týdnů po prvním podání. Účinnost (definovaná jako odpověď PASI 75 a IGA mod 2011 „čistá“ nebo „téměř čistá“ [0 nebo 1]) byla pozorována již při první návštěvě po základní návštěvě ve 2. týdnu a podíly pacientů, kteří dosáhli odpovědi PASI 75 a IGA mod 2011 „čistá“ nebo „téměř čistá“ (0 nebo 1) vzrostly až do 24. týdne a byly udržovány až do 52. týdne. Zlepšení v PASI 90 a PASI 100 bylo také pozorováno ve 12. týdnu a zvýšeno až do 24. týdne a bylo udržováno do 52. týdne (viz tabulka 17).
Bezpečnostní profily nízké dávky a vysoké dávky byly srovnatelné a konzistentní s bezpečnostním profilem u dospělých.
Tabulka 17 Přehled klinické odpovědi u středně těžké až těžké pediatrické psoriázy v týdnech 12 a 52 (pediatrická studie psoriázy 2)*
Týden 12 Týden 52 nízká dávka vysoká dávka nízká dávka vysoká dávka Počet pacientů 42 42 42 42 Odpověď PASI 75n (%) 39 (92,9 %) 39 (92,9 %) 37 (88,1 %) 38 (90,5 %) Odpověď IGA mod 2011 „čistá“ nebo „téměř čistá“ n (%) 33 (78,6 %) 35 (83,3 %) 36 (85,7 %) 35 (83,3 %) Odpověď PASI 90n (%) 29 (69 %) 32 (76,2 %) 32 (76,2 %) 35 (83,3 %) Odpověď PASI 100n (%) 25 (59,5 %) 23 (54,8 %) 22 (52,4 %) 29 (69,0 %) * u chybějících hodnot non-respondérů byla použita imputace Tyto výsledky u pediatrické populace se středně těžkou až těžkou ložiskovou psoriázou potvrdily výše uvedené prediktivní předpoklady na základě vztahu účinnosti a expozice u dospělých pacientů.
Ve skupině s nízkou dávkou dosáhlo 50 % a 70,7 % pacientů skóre CDLQI 0 nebo 1 ve 12. a 52. týdnu. Ve skupině s vysokou dávkou dosáhlo 61,9 % a 70,3 % skóre CDLQI 0 nebo 1 ve 12. a 52. týdnu.
Juvenilní idiopatická artritida (JIA)
Artritida související s entezitidou (ERA) a juvenilní psoriatická artritida (JPsA)
Bezpečnost a účinnost sekukinumabu byly hodnoceny u 86 pacientů ve 3 částech dvojitě zaslepené, placebem kontrolované, událostmi řízené (event-driven), randomizované studie fáze III u pacientů ve věku od 2 do <18 let s aktivní ERA nebo JPsA, kteří byli diagnostikováni podle modifikovaných JIA klasifikačních kritérií Mezinárodní ligy asociací pro revmatologii (International League of Associations for Rheumatology, ILAR). Studie se skládala z otevřené fáze (část 1), ve které všichni pacienti dostávali sekukinumab do 12. týdne. Pacienti, kteří ve 12. týdnu dosáhli odpovědi JIA ACR30, vstoupili do dvojitě zaslepené fáze (část 2), kde byli randomizováni v poměru 1:1, aby pokračovali v léčbě sekukinumabem nebo byli převedeni na placebo (randomizované vysazení) do 104. týdne nebo do výskytu příznaků vzplanutí. Pacienti se vzplanutím onemocnění vstoupili do otevřené studie, ve které byli léčeni sekukinumabem do 104. týdne (část 3).Při zařazení do studie měli pacienti s JIA v 60,5 % podtyp ERA a 39,5 % podtyp JPsA a vykazovali nedostatečnou odpověď nebo intoleranci na ≥1 chorobu modifikující antirevmatika (DMARD) a ≥1 nesteroidní antiflogistika (NSAID). Při zahájení studie bylo hlášeno užívání MTX u 65,1 % pacientů; (63,5 % [33/52] pacientů s ERA a 67,6 % [23/34] pacientů s JPsA). Dvanáct z 52 pacientů s ERA současně užívalo sulfasalazin (23,1 %). Pacienti s tělesnou hmotností <50 kg (n=30) při zahájení studie dostávali dávku 75 mg a pacienti s tělesnou hmotností ≥50 kg (n=56) dostávali dávku 150 mg. Věkové rozmezí při zahájení studie bylo od 2 do 17 let, 3 pacienti byli ve věku 2 až <6 let, 22 pacientů ve věku 6 až <12 let a 61 pacientů ve věku 12 až <18 let. Skóre JADAS-27 bylo při zahájení studie 15,1 (SD: 7,1).
Primárním cílovým parametrem byla doba do vzplanutí onemocnění ve fázi randomizovaného vysazení (část 2). Vzplanutí onemocnění bylo definováno jako ≥30% zhoršení odpovědi JIA ACR u alespoň tří ze šesti kritérií a ≥30% zlepšení odpovědi JIA ACR u ne více jak jednoho ze šesti kritérií a minimálně dvou aktivních kloubů.
Na konci části 1 dosáhlo 75 pacientů z 86 (87,2 %) odpovědi JIA ACR30 a vstoupilo do části 2.
Ve studii byl splněn primární cíl, protože bylo prokázáno statisticky významné prodloužení doby do vzplanutí onemocnění u pacientů léčených v části 2 sekukinumabem ve srovnání s placebem. U pacientů léčených v části 2 sekukinumabem bylo riziko vzplanutí sníženo o 72 % ve srovnání s pacienty, kterým bylo podáváno placebo (poměr rizika = 0,28; 95% CI: 0,13 až 0,63, p<0,001) (obrázek 4 a tabulka 18). Během části 2 došlo ke vzplanutí onemocnění celkem u 21 pacientů ve skupině s placebem (11 JPsA a 10 ERA) ve srovnání s 10 pacienty ve skupině se sekukinumabem (4 JPsA a 6 ERA).
Obrázek 4 Doba do vzplanutí onemocnění v části 2 podle metody Kaplana-Meiera
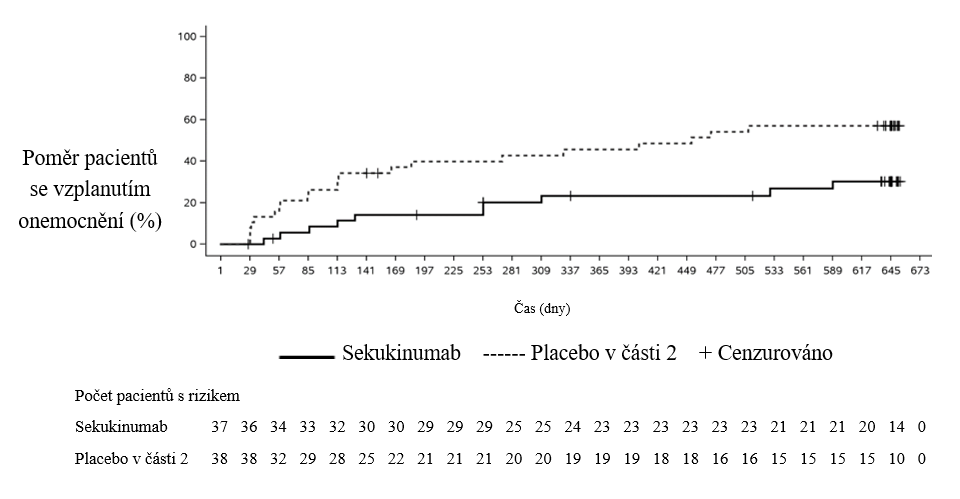
Tabulka 18 Analýza doby přežívání do vzplanutí onemocnění v části 2
(n=37) Placebo v části 2
(n=38)počet případů vzplanutí na konci části 2, n (%) 10 (27,0) 21 (55,3) Kaplanova-Meierova metoda: medián ve dnech (95% CI) NC (NC, NC) 453,0 (114,0; NC) poměr bez vzplanutí v 6. měsíci (95% CI) 85,8 (69,2; 93,8) 60.1 (42.7, 73.7) poměr bez vzplanutí ve 12. měsíci (95% CI) 76,7 (58,7; 87,6) 54,3 (37,1; 68,7) poměr bez vzplanutí v 18. měsíci (95% CI) 73,2 (54,6; 85,1) 42,9 (26,7; 58,1) poměr rizik k placebu: odhad (95% CI) 0,28 (0,13; 0,63) p‑hodnota ze stratifikovaného log‑rank testu <0,001** Analýza byla provedena u všech randomizovaných pacientů, kteří v části 2 dostali alespoň jednu dávku studijní medikace.
Sekukinumab: všichni pacienti, kteří nedostali žádné placebo. Placebo v části 2: všichni pacienti, kteří v části 2 užívali placebo a v další části/dalších částech užívali sekukinumab. NC = nelze spočítat. ** = Statisticky významná hodnota pro jednostrannou hladinu významnosti 0,025.V otevřené části 1 dostávali všichni pacienti sekukinumab do 12. týdne. Ve 12. týdnu dosáhlo 83,7 % dětí odpovědi JIA ACR50; 67,4 % odpovědi JIA ACR70 a 38,4 % odpovědi JIA ACR90 (obrázek 5). Nástup účinku sekukinumabu nastal již v 1. týdnu. Ve 12. týdnu bylo skóre JADAS-27 4,64 (SD:4,73) a průměrné snížení od výchozí hodnoty JADAS-27 bylo -10,487 (SD:7,23).
Obrázek 5 Odpověď JIA ACR30/50/70/90 u subjektů v části 1 do 12. týdne*
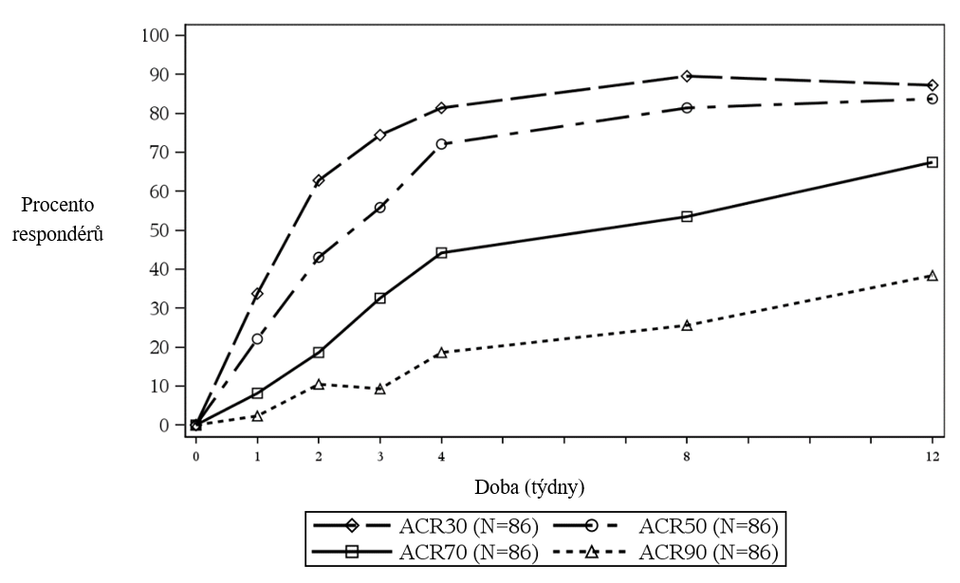
* u chybějících hodnot non-respondérů byla použita imputace
Údaje pro věkovou skupinu od 2 do <6 let jsou neprůkazné vzhledem k malému počtu pacientů mladších 6 let zahrnutých do studie.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Cosentyx u chronické idiopatické artritidy u dětských pacientů do 2 let (informace o použití u dětí viz bod 4.2).
-
-
5.2 Farmakokinetické vlastnosti
Většina farmakokinetických vlastností u pacientů s ložiskovou psoriázou, psoriatickou artritidou a ankylozující spondylitidou byla podobná.
-
Absorpce
Po jednorázové podkožní dávce 300 mg ve formě roztoku u zdravých dobrovolníků dosáhl sekukinumab nejvyšší sérové koncentrace 43,2±10,4 μg/ml mezi 2 a 14 dny po podání dávky.
Na základě výsledků populační farmakokinetické analýzy sekukinumab po jednorázové subkutánní dávce buď 150 mg nebo 300 mg u pacientů s ložiskovou psoriázou dosáhl nejvyšší sérové koncentrace 13,7±4,8 µg/ml a 27,3±9,5 µg/ml mezi 5 a 6 dny od podání dávky.
Na základě výsledků populační farmakokinetické analýzy byl po počátečním týdenním dávkování během prvního měsíce čas potřebný k dosažení maximální koncentrace mezi 31 a 34 dny.
Podle simulovaných údajů byla nejvyšší koncentrace v rovnovážném stavu (Cmax,ss) po subkutánním podání dávky 150 mg nebo 300 mg 27,6 µg/ml a 55,2 µg/ml. Populační farmakokinetická analýza naznačuje, že rovnovážného stavu je dosaženo po 20 týdnech při měsíčním dávkovacím režimu.
V porovnání s expozicí po jednorázovém podání ukázala populační farmakokinetická analýza, že pacienti vykazovali 2násobné zvýšení nejvyšší sérové koncentrace a plochy pod křivkou (AUC) po opakovaném měsíčním podávání během udržovacího režimu.
Populační farmakokinetická analýza ukázala že sekukinumab byl u pacientů s ložiskovou psoriázou absorbován s průměrnou absolutní biologickou dostupností 73 %. Napříč studiemi byla vypočítaná absolutní biologická dostupnost v rozmezí 60 až 77 %.
Biologická dostupnost sekukinumabu u pacientů s PsA byla podle populačního farmakokinetického modelu 85 %.
Po jednorázové subkutánní injekci obsahující 300 mg injekčního roztoku v předplněné injekční stříkačce u pacientů s psoriázou s plaky byla systémová expozice sekukinumabu podobná té, která byla pozorována dříve po podání dvou injekcí po 150 mg.
Po subkutánním podání sekukinumabu 300 mg v týdnech 0, 1, 2, 3 a 4 a následně 300 mg každé 2 týdny byla průměrná minimální koncentrace ±SD v ustáleném stavu v týdnu 16 přibližně 55,1 ± 26,7 µg/ml v HS studii 1 a 58,1 ± 30,1 µg /ml v HS studii 2.
-
Distribuce
Průměrný distribuční objem během terminální fáze (Vz) po jednorázovém intravenózním podání kolísal u pacientů s ložiskovou psoriázou v rozmezí od 7,10 do 8,60 litrů, což naznačuje, že sekukinumab se omezeně distribuuje do periferních kompartmentů.
-
Biotransformace
Největší část IgG eliminace probíhá prostřednictvím intracelulárního katabolismu, následovaného fluidní fází nebo receptory zprostředkované endocytózy.
-
Eliminace
Průměrná systémová clearance (CL) po jednorázovém intravenózním podání kolísala u pacientů s ložiskovou psoriázou od 0,13 do 0,36 l/den. V populační farmakokinetické analýze byla průměrná systémová clearance (CL) u pacientů s ložiskovou psoriázou 0,19 l/den. CL nebyla ovlivněna pohlavím. Clearance byla závislá na dávce a čase.
Průměrný eliminační poločas zjištěný v populační farmakokinetické analýze byl u pacientů s ložiskovou psoriázou 27 dní, a kolísal od 18 do 46 dní napříč psoriatickými studiemi s intravenózním podáním.
V populační farmakokinetické analýze byl průměrný systémový CL po subkutánním podání 300 mg v týdnech 0, 1, 2, 3 a 4 a následně 300 mg každé 2 týdny pacientům s hidradenitidou 0,26 l/den.
Průměrný eliminační poločas odhadnutý z populační farmakokinetické analýzy byl 23 dní u pacientů s hidradenitidou.
-
Linearita/nelinearita
Farmakokinetika sekukinumabu u pacientů s ložiskovou psoriázou po jednotlivé a opakovaných dávkách byla stanovena v četných studiích s intravenózně podanými dávkami v rozmezí od 1x 0,3 mg/kg do 3x 10 mg/kg a subkutánními dávkami v rozmezí od 1x 25 mg až opakovanými dávkami 300 mg. Expozice ve všech dávkovacích režimech odpovídala dávce.
-
Zvláštní populace
Starší pacienti
Na základě populační farmakokinetické analýzy s omezeným počtem starších pacientů (n=71 pro věk ≥65 let a n=7 pro věk ≥75 let) byla clearance u starších pacientů a pacientů mladších 65 let věku podobná.Pacienti s poruchou funkce ledvin nebo jater
U pacientů s poruchou funkce ledvin nebo jater nejsou k dispozici farmakokinetická data. Předpokládá se, že renální eliminace nedotčeného sekukinumabu, IgG monoklonální protilátky bude nízká a nevýznamná. IgG jsou většinou katabolizovány a neočekává se, že by porucha funkce jater ovlivnila clearance sekukinumabu.Vliv tělesné hmotnosti na farmakokinetiku
S rostoucí tělesnou hmotností rostou clearance sekukinumabu a jeho distribuční objem.Pediatrická populace
Ložisková psoriáza
V souboru dvou pediatrických studií byl pacientům se středně těžkou až těžkou ložiskovou psoriázou (ve věku od 6 do 18 let) podán sekukinumab v doporučeném dávkovacím režimu pro děti. Ve 24. týdnu měli pacienti s hmotností ≥25 a <50 kg průměrnou minimální koncentraci ± SD v ustáleném stavu 19,8 ± 6,96 µg/ml (n=24) po podání 75 mg sekukinumabu a u pacientů s hmotností ≥50 kg byla průměrná minimální koncentrace ±SD 27,3 ± 10,1 µg/ml (n=36) po podání 150 mg sekukinumabu. Průměrná minimální koncentrace v ustáleném stavu ± SD u pacientů s hmotností <25 kg (n=8) byla ve 24. týdnu 32,6 ± 10,8 µg/ml po podání dávky 75 mg.Juvenilní idiopatická artritida
Pacientům s ERA a JPsA (ve věku od 2 do méně než 18 let) byl v pediatrické studii podáván sekukinumab v doporučeném pediatrickém dávkovacím režimu. Ve 24. týdnu měli pacienti s tělesnou hmotností <50 kg průměrnou nejnižší ± SD koncentraci v ustáleném stavu 25,2±5,45 µg/ml (n=10), hodnota u pacientů s tělesnou hmotností ≥50 kg byla 27,9±9,57 µg/ml (n=19).
-
-
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a reprodukční toxicity, nebo tkáňových testů zkřížené reaktivity, neodhalily žádné zvláštní riziko pro člověka (dospělí nebo pediatričtí pacienti).
Studie na zvířatech k posouzení karcinogenního potenciálu sekukinumabu nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
-
6.1 Seznam pomocných látek
Dihydrát trehalosy
Histidin
Monohydrát histidin-hydrochloridu
Methionin
Polysorbát 80
Voda pro injekci
-
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
-
6.3 Doba použitelnosti
2 roky
V případě nutnosti může být Cosentyx jednorázově uchován nechlazený po dobu maximálně 4 dní při pokojové teplotě nepřesahující 30 °C.
-
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
-
6.5 Druh obalu a obsah balení
-
Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce
Přípravek Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce je dodáván v předplněné skleněné injekční stříkačce o objemu 1 ml se silikonem potaženým pístem z bromobutylové pryže, připojenou 27G x ½″ jehlou a pevným krytem jehly ze styrenbutadienové gumy zabudované v automatickém chrániči jehly z polykarbonátu.
Přípravek Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce je dostupný v jednotkovém balení obsahujícím 1 nebo 2 předplněné injekční stříkačky a vícečetném balení obsahujícím 6 (3 balení po 2) předplněných injekčních stříkaček.
-
Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce
Přípravek Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce je dodáván v předplněné skleněné injekční stříkačce o objemu 2,25 ml se silikonem potaženým pístem z bromobutylové pryže, připojenou 27G x ½″ jehlou a pevným krytem jehly z polyisoprenové gumy zabudované v automatickém chrániči jehly z polykarbonátu.
Přípravek Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce je dostupný v jednotkovém balení obsahujícím 1 předplněnou injekční stříkačku a ve vícečetném balení obsahujícím 3 (3 balení po 1) předplněné injekční stříkačky.
-
Cosentyx 150 mg injekční roztok v předplněném peru
Přípravek Cosentyx je dodáván v jednorázové předplněné injekční stříkačce vložené do pera trojúhelníkového tvaru s průhledným okénkem a štítkem. Předplněná injekční stříkačka uvnitř pera je skleněná injekční stříkačka o objemu 1 ml se silikonem potaženým pístem z bromobutylové pryže, připojenou 27G x ½″ jehlou a pevným krytem jehly ze styrenbutadienové gumy.
Přípravek Cosentyx je dostupný v jednotkovém balení obsahujícím 1 nebo 2 předplněná pera a vícečetném balení obsahujícím 6 (3 balení po 2) předplněných per.
-
Cosentyx 300 mg injekční roztok v předplněném peru
Přípravek Cosentyx je dodáván v jednorázové předplněné injekční stříkačce vložené do pera čtvercového tvaru s průhledným okénkem a štítkem. Předplněná injekční stříkačka uvnitř pera je skleněná injekční stříkačka o objemu 2,25 ml se silikonem potaženým pístem z bromobutylové pryže, připojenou 27G x ½″ jehlou a pevným krytem jehly z polyisoprenové gumy.
Přípravek Cosentyx je dostupný v jednotkovém balení obsahujícím 1předplněné pero a ve vícečetném balení obsahujícím 3 (3 balení po 1) předplněná pera.
Na trhu nemusí být všechny velikosti balení.
-
-
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
-
Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce
Přípravek Cosentyx 150 mg injekční roztok je dodáván v jednorázové předplněné injekční stříkačce pro individuální použití. Injekční stříkačku je nutné vyjmout z chladničky 20 minut před aplikací injekce, aby dosáhla pokojové teploty.
-
Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce
Přípravek Cosentyx 300 mg injekční roztok je dodáván v jednorázové předplněné injekční stříkačce pro individuální použití. Injekční stříkačku je nutné vyjmout z chladničky 30-45 minut před aplikací injekce, aby dosáhla pokojové teploty.
-
Cosentyx 150 mg injekční roztok v předplněném peru
Přípravek Cosentyx 150 mg injekční roztok je dodáván v jednorázovém předplněném peru pro individuální použití. Pero je nutné vyjmout z chladničky 20 minut před aplikací injekce, aby dosáhla pokojové teploty.
-
Cosentyx 300 mg injekční roztok v předplněném peru
Přípravek Cosentyx 300 mg injekční roztok je dodáván v jednorázovém předplněném peru pro individuální použití. Pero je nutné vyjmout z chladničky 30-45 minut před aplikací injekce, aby dosáhla pokojové teploty.
Před použitím předplněné injekční stříkačky nebo předplněného pera se doporučuje provést vizuální kontrolu. Roztok musí být čirý. Jeho barva může být od bezbarvé po mírně nažloutlou. Můžete pozorovat malé vzduchové bublinky, což je normální. Nepoužívejte, pokud roztok obsahuje zřetelně viditelné částice, je zakalený nebo zřetelně hnědý.
Podrobný návod k použití najdete v příbalové informaci.Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
-
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irsko
8. REGISTRAČNÍ ČÍSLO/REGISTRAČNÍ ČÍSLA
-
Cosentyx 150 mg injekční roztok v předplněné injekční stříkačce
EU/1/14/980/002
EU/1/14/980/003
EU/1/14/980/006
-
Cosentyx 300 mg injekční roztok v předplněné injekční stříkačce
EU/1/14/980/008-009
-
Cosentyx 150 mg injekční roztok v předplněném peru
EU/1/14/980/004
EU/1/14/980/005
EU/1/14/980/007
-
Cosentyx 300 mg injekční roztok v předplněném peru
EU/1/14/980/010-011
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. ledna 2015
Datum posledního prodloužení registrace: 3. září 2019
10. DATUM REVIZE TEXTU
13. února 2025
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky https://www.ema.europa.eu.